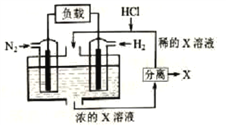
题目内容
【题目】六氟化硫分子(如图)呈正八面体,难以水解,在电器工业方面有着广泛用途。下列有关SF6的推测正确的是( )

A. 高温条件下,SF6微弱水解生成H2SO4和HF
B. SF6易燃烧生成二氧化硫
C. SF6中各原子均达到 8 电子稳定结构
D. 六氟化硫分子中的S—F键都是σ键,键长、键能不完全相等
【答案】A
【解析】SF6难以水解,但在高温条件下,SF6微弱水解,反应方程式:SF6+4H2O![]() H2SO4+6HF,所以A选项正确;在SF6中S元素为+6价,S已处于最高价,不可能再被氧气氧化生成硫为+4价的二氧化硫,B选项错误;六氟化硫分子呈正八面体,F原子达到八电子稳定结构,1个F原子最外层周围有8个电子,1个S原子最外层周围有12个电子,C选项错误;六氟化硫分子为正八面体构型,根据题干的图示,S—F键是单键,所以S—F键是σ键,因为是正八面体结构,所以键长、键能都相同,D选项错误,正确答案A。
H2SO4+6HF,所以A选项正确;在SF6中S元素为+6价,S已处于最高价,不可能再被氧气氧化生成硫为+4价的二氧化硫,B选项错误;六氟化硫分子呈正八面体,F原子达到八电子稳定结构,1个F原子最外层周围有8个电子,1个S原子最外层周围有12个电子,C选项错误;六氟化硫分子为正八面体构型,根据题干的图示,S—F键是单键,所以S—F键是σ键,因为是正八面体结构,所以键长、键能都相同,D选项错误,正确答案A。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(1)天冬酰胺所含元素中,________(填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有________种。
(3)H2S和H2Se的参数对比见下表。
化学式 | 键长/nm | 键角 | 沸点/℃ |
H2S | 1.34 | 92.3° | -60.75 |
H2Se | 1.47 | 91.0° | -41.50 |
①H2Se分子中含有的共价键类型为_____________(填“σ”或“π”)。
②H2S的键角大于H2Se的原因可能为______________________________。
③H2Se的酸性比H2S________(填“强”或“弱”)。
(4)已知钼(Mo)位于第五周期ⅥB族,钼、铬、锰的部分电离能如下表所示:
编号 | I5/kJ·mol-1 | I6/kJ·mol-1 | I7/kJ·mol-1 | I8/kJ·mol-1 |
A | 6990 | 9220 | 11500 | 18770 |
B | 6702 | 8745 | 15455 | 17820 |
C | 5257 | 6641 | 12125 | 13860 |
A是____________(填元素符号),B的价电子排布式为____________。