题目内容
城市使用的燃料,现大多为煤气、液化石油气.煤气的主要成分是CO和H2的混合气体,它由煤炭与水蒸汽在高温下反应制得,故又称水煤气.试解答:
(1)制取水煤气的主要化学方程式为________.该反应为________(填“吸热”、“放热”)反应.
(2)设液化石油气的主要成分为丙烷(C3H8),其充分燃烧后产物为CO2和H2O.试比较完全燃烧等质量的C3H8及CO所需的氧气的体积比(同温、同压下)为________.
(3)氢气是未来的理想能源,燃烧时除产生热量高以外,还具有的两大优点是________.
(4)使用管道煤气必须防止因煤气泄漏而引起的中毒和爆炸.某住房因煤气泄漏而发生爆炸事故.调查发现煤气是在达到室内空气质量的6%时发生爆炸的,该住户煤气泄漏的速度为0.6g/min,问爆炸时煤气已泄漏约________小时.(假设厨房体积为25m3,空气密度为1.29g·L-1)
解析:
|
(1)C(s)+H2O(g) (2)70∶11 (3)燃烧后无污染;来源丰富 (4)5.36 导解:(1)C(s)+H2O(g) (2)由C3H8+5O2 44 160 56 32 知,完全燃烧等质量的C3H8和CO所需O2的质量比为 (3)H2是最洁净的能源,燃烧产物为水,不污染环境,也不产生温室效应.再者H2来源丰富.(4)厨房内的空气质量:25m3×1000L·m-3×1.29g·L-1=32250g, 泄漏煤气的质量:32250g×6%=1935g, 泄漏时间:1935g÷6g·min-1÷60min·h-1=5.36h. |

(8分)城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式____________________________.
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为
C3H8(g) +5O2(g)
== 3CO2(g) + 4H2O(l);△H=–2220.0 kJ· ,
,
又知CO气体燃烧的热化学方程式为:
CO(g) +1/2O2(g) == CO2(g) ;△H=–282.57kJ· ,
,
试比较同质量的C3H8和CO燃烧,产生的热量比值约为_________:1。
(3)已知氢气燃烧的热化学方程式为2H2(g)
+ O2(g) == 2H2O(l);△H=–571.6 kJ· ,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
(4)氢气是未来的能源,除来源丰富之外,还具有的优点是____________________
 CO(g)+H2(g),吸热
CO(g)+H2(g),吸热 3CO2+4H2O和2CO+O2
3CO2+4H2O和2CO+O2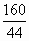 ∶
∶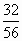 =70∶11.
=70∶11. ,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。 ,
,