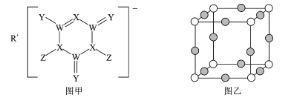
题目内容
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是
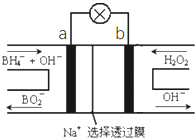
A.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
B.电极a采用MnO2,MnO2既作电极材料又有催化作用
C.电池放电时Na+从b极区移向a极区
D.电池的负极反应为![]() +2H2O﹣8e-=
+2H2O﹣8e-=![]() +8H+
+8H+
【答案】A
【解析】
BH![]() 中H元素为-1价,放电过程中a电极上BH
中H元素为-1价,放电过程中a电极上BH![]() 中H元素被氧化,所以a为负极,b电极上H2O2中氧元素被还原,所以b为正极。
中H元素被氧化,所以a为负极,b电极上H2O2中氧元素被还原,所以b为正极。
A.负极H元素发生氧化反应生成H2O,电极反应式为BH![]() +8OH﹣-8e﹣=BO
+8OH﹣-8e﹣=BO![]() +6H2O,每转移2mol电子,理论上需要消耗0.25mol即9.5gNaBH4,故A正确;
+6H2O,每转移2mol电子,理论上需要消耗0.25mol即9.5gNaBH4,故A正确;
B.电极a为负极,二氧化锰具有氧化性,可以直接氧化硼氢根离子,不能用作负极的材料,故B错误;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,则Na+从a极区移向b极区,故C错误;
D.负极H元素发生氧化反应生成H2O,电极反应式为BH![]() +8OH﹣-8e﹣=BO
+8OH﹣-8e﹣=BO![]() +6H2O,故D错误;
+6H2O,故D错误;
故选A.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目