题目内容
【题目】把煤作为燃料可通过下列两种途径获得热量:
途径Ⅰ:C(s)+O2(g)═CO2(g) △H1<0 ①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g) △H3<0 ③
2H2(g)+O2(g)═2H2O(g) △H4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上____(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)途径Ⅱ在制水煤气的反应里,反应物所具有的总能量____生成物所具有的总能量(填“大于”、“等于”或“小于”),因此在反应时,反应物就需要___能量才能转化为生成物。
(3)途径I中通常将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是______
①使煤充分燃烧,提高能量的转化率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
(4)△H1、△H2、△H3、△H4的数学关系式是____________________
【答案】等于 小于 吸收 ①②③ △H1=△H2 +![]() (△H3+△H4)
(△H3+△H4)
【解析】
(1)根据盖斯定律,反应热只与始态与终态有关,与途径无关,始态相同、终态相同反应热相同;
(2)途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g) △H2>0,反应吸热,所以反应物所具有的总能量小于生成物所具有的总能量,故填小于;
(3)将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是使煤充分燃烧,提高能量的转化率;减少SO2的产生,避免造成“酸雨”, 减少有毒的CO产生,避免污染空气,故选①②③;
(4)C(s)+H2O(g)═CO(g)+H2(g);△H2>0 ②
2CO(g)+O2(g)═2CO2(g);△H3<0 ③
2H2(g)+O2(g)═2H2O(g);△H4<0 ④
根据盖斯定律,②+③×![]() +④×
+④×![]() 得C(s)+O2(g)═CO2(g),故△H1=△H2+
得C(s)+O2(g)═CO2(g),故△H1=△H2+![]() (△H3+△H4)故答案为:△H1=△H2+
(△H3+△H4)故答案为:△H1=△H2+![]() (△H3+△H4)。
(△H3+△H4)。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
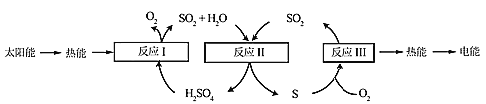
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示:
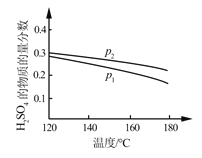
p2_______p 1(填“>”或“<”)。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________=_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
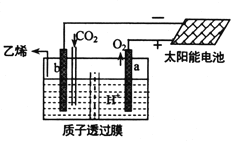
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示。则b电极上的电极反应式为__________________。
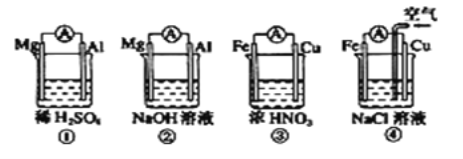
【题目】下列实验操作与实验目的对应的是 ( )
实验操作 | 实验目的 |
A、向淀粉水解液中直接滴加碘水 | 检验淀粉是否完全水解 |
B、C2H4 与SO2 混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去 C2H4 中的SO2 |
C、 将电石和饱和氯化钠溶液反应生成的气体通入饱和硫酸铜溶液中 | 验证生成的是乙炔气体 |
D、将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴 |
A.AB.BC.CD.D