题目内容
(本题共14分)X、Y、Z、W为短周期的主族元素,其原子序数依次增大。X元素形成的单质是自然界中含量最多的气体。Y是电负性最大的元素。W的原子最外层电子数与核外电子总数之比为3∶8。X的原子序数是Z的原子序数的一半。U原子基态的外围电子排布为3d104s1。
(1)Z基态的核外电子排布式 ,U在周期表中位置为 。
(2)在Y的氧化物OY2中,氧原子的杂化轨道类型是 。
(3)在银氨溶液中通入W的气态氢化物,会出现黑色沉淀,该反应的离子方程式是 。
(4)1molX的气态氢化物在800~900℃下催化氧化放出226.25KJ热量。该反应的热化学方程式为 _ 。
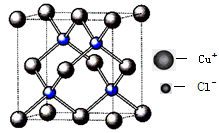
(5)U的含氧化合物M晶胞如右图所示(“○”表示氧原子),则M的化学式为 ;氧原子的配位数为 。
(1)Z基态的核外电子排布式 ,U在周期表中位置为 。
(2)在Y的氧化物OY2中,氧原子的杂化轨道类型是 。
(3)在银氨溶液中通入W的气态氢化物,会出现黑色沉淀,该反应的离子方程式是 。
(4)1molX的气态氢化物在800~900℃下催化氧化放出226.25KJ热量。该反应的热化学方程式为 _ 。
(5)U的含氧化合物M晶胞如右图所示(“○”表示氧原子),则M的化学式为 ;氧原子的配位数为 。

(1)1s22s22p63s23p2 ;第四周期IB族(各2分,共4分) (2)sp3(2分)
(3)2Ag(NH3)2+ + 2OH- + H2S = Ag2S↓ + 2H2O + 4NH3(2分)
(4)4NH3(g) +5O2(g) =4NO(g)+ 6H2O(g) △H=-905kJ/mol(方程式正确1分,热量正确1分,共2分) (5)Cu2O; 4 (各2分,共4分)
(3)2Ag(NH3)2+ + 2OH- + H2S = Ag2S↓ + 2H2O + 4NH3(2分)
(4)4NH3(g) +5O2(g) =4NO(g)+ 6H2O(g) △H=-905kJ/mol(方程式正确1分,热量正确1分,共2分) (5)Cu2O; 4 (各2分,共4分)
试题分析:X、Y、Z、W为短周期的主族元素,其原子序数依次增大。X元素形成的单质是自然界中含量最多的气体,因此X是氮元素。Y是电负性最大的元素,则Y是氟元素。W的原子最外层电子数与核外电子总数之比为3∶8,且W是四种短周期元素中原子序数最大的,因此W是第三周期元素,则W是硫元素。X的原子序数是Z的原子序数的一半,即Z的原子序数是14,因此Z是硅元素。U原子基态的外围电子排布为3d104s1,则U的原子序数是29,即为铜元素。
(1)根据原子核外电子排布规律可知硅元素基态的核外电子排布式为1s22s22p63s23p2,铜元素在周期表中位置为第四周期IB族。
(2)在Y的氧化物OF2中,氧原子含有的孤电子对数=(6-2×1)÷2=2,即氧原子的价层电子对数是4,所以氧原子的杂化轨道类型是sp3。
(3)在银氨溶液中通入W的气态氢化物硫化氢,会出现黑色沉淀,该沉淀应该是硫化银,因此反应的离子方程式是2Ag(NH3)2+ + 2OH- + H2S = Ag2S↓ + 2H2O + 4NH3。
(4)氨气催化氧化生成NO和水,若1molX的气态氢化物在800~900℃下催化氧化放出226.25KJ热量,则该反应的热化学方程式为4NH3(g) +5O2(g) =4NO(g)+ 6H2O(g) △H=-905kJ/mol。
(5)根据晶胞结构可知,晶胞中含有铜原子的数是4个,而氧原子数是1+8×1/8=2,所以M的化学式为Cu2O;根据晶胞结构可知氧原子周围距离最近的铜原子个数是4个,所以氧原子的配位数为4。

练习册系列答案
相关题目



 4FeCl2+N2O↑+6HCl+H2O
4FeCl2+N2O↑+6HCl+H2O




