题目内容
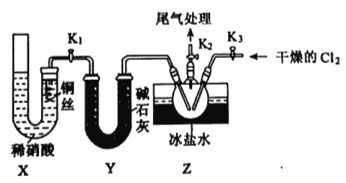
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。

查阅资料可知:
①2NO+Na2O2=2NaNO2;2NO2+Na2O2 =2NaNO3。
②NO能被酸性KMnO4氧化成NO3-。
(1)A中滴入浓硝酸之前,应先通入N2一段时间,目的是____________。 A中反应的化学方程式_____________。
(2)装置B中观察到的主要现象______________。
(3)装置C中盛放的试剂是______________。
(4)装置E的作用是______________。
(5)写出NO被酸性KMnO4氧化的离子反应方程式______________。
【答案】 排尽装置中的空气,防止对后续实验有干扰 C+4HNO3![]() CO2↑+4NO2↑+2H2O 溶液变蓝,铜片溶解,有无色气体冒出 碱石灰(或生石灰或氢氧化钠固体) 吸收有毒气体NO,防止空气污染 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
CO2↑+4NO2↑+2H2O 溶液变蓝,铜片溶解,有无色气体冒出 碱石灰(或生石灰或氢氧化钠固体) 吸收有毒气体NO,防止空气污染 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O
【解析】根据实验原理分析,本实验不能有氧气,要排除氧气的干扰,由实验装置可以知道,A中发生C+4HNO3![]() CO2↑+4NO2↑+2H2O ,B中吸收挥发的硝酸和生成的二氧化氮,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2=2NaNO2,E中高锰酸钾吸收尾气NO,以此分析。
CO2↑+4NO2↑+2H2O ,B中吸收挥发的硝酸和生成的二氧化氮,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2=2NaNO2,E中高锰酸钾吸收尾气NO,以此分析。
详解:(1)为了排除氧气干扰,A中滴入浓硝酸之前,应先通入一段时间N2;A中发生C+4HNO3![]() CO2↑+4NO2↑+2H2O,因此,本题正确答案是: 排尽装置中的空气,防止对后续实验有干扰; C+4HNO3
CO2↑+4NO2↑+2H2O,因此,本题正确答案是: 排尽装置中的空气,防止对后续实验有干扰; C+4HNO3![]() CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;
(2)B中水吸收二氧化氮将NO2转化为NO、二氧化氮溶于水生成硝酸,铜与稀硝酸反应生成NO,现象有:溶液变蓝,铜片溶解,有无色气体冒出;
因此,本题正确答案是: 溶液变蓝,铜片溶解,有无色气体冒出;
(3)C中盛放的试剂是用来干燥NO,并除去可能混有的酸雾,故应用碱石灰(或生石灰或氢氧化钠固体),因此,本题正确答案是: 碱石灰(或生石灰或氢氧化钠固体);
(4)由信息可以知道,E装置的作用是利用高锰酸钾溶液的强氧化性氧化吸收有毒气体一氧化氮,吸收有毒的NO气体,避免污染空气, 因此,本题正确答案是:吸收有毒气体NO,防止空气污染;
(5)根据信息:NO被酸性KMnO4氧化成NO3-,根据电子守恒和电荷守恒及原子守恒写出离子反应方程式为: 5NO+3MnO4-+4H+==5NO3-+3Mn2++2H2O,
因此,本题正确答案是: 5NO+3MnO4-+4H+==5NO3-+3Mn2++2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案