题目内容
有某种含有少量氯化亚铁杂质的FeCl3样品,现要测定其中铁元素的质量分数,实验采取以下步骤进行:①准确称量m g样品(在2~3 g范围内)。
②向样品中加入10 mL 6 mol·L-1盐酸,再加入蒸馏水,配制250 mL溶液。
③量取25 mL操作②中配得的溶液,加入3 mL溴水,加热使反应完全。
④趁热迅速加入10%氨水至过量,充分搅拌,使沉淀完全。
⑤过滤,将沉淀洗涤、灼烧、冷却、称量,反复操作至恒量。
根据以上叙述,完成下列问题:
(1)在称量样品时,若称量前天平的指针偏向标尺左方,称量读数时,指针刚好在标尺中央,所得样品质量________(填编号)。
A.比m g多 B.比m g少 C.恰好m g
(2)溶解样品时要加入盐酸,原因是_______________________________________________。
(3)加入溴水后,发生反应的离子方程式为__________________________________________。
(4)加入氨水要过量的原因是____________________________________________________。
(5)检验沉淀是否洗涤干净的方法是_______________________________________________。
(6)若坩埚质量为W1 g,坩埚与灼烧后固体的总质量为W2 g,则样品中铁元素的质量分数是___________。
(1)B(2)抑制Fe3+水解,以免溶解时产生浑浊
(3)2Fe2++Br2====2Fe3++2Br-
(4)使Fe3+完全转化为Fe(OH)3沉淀
(5)取少量最后洗涤液,加入AgNO3溶液,若无沉淀产生,证明已洗涤干净
(6)![]() ×100%
×100%
解析:(1)托盘天平指针偏向标尺左方,说明称量前左盘重于右盘,根据左物右码和左边质量=右边质量+游码质量的原则可知样品的质量比m g要少。
(2)FeCl3溶液配制时,Fe3+易发生水解而使溶液产生浑浊,故要加盐酸抑制Fe3+的水解。
(5)若沉淀没有洗涤干净,则沉淀表面附有Cl-、Na+等离子,只要检验洗涤液中无Cl-,则沉淀就洗涤干净了。
(6)由题意可知最后灼烧后所得固体即Fe2O3的质量为(W2-W1) g。
所以w(Fe)=![]() ×100%
×100%

 名题金卷系列答案
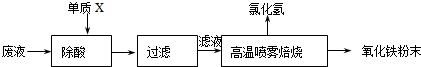
名题金卷系列答案大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料。

(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末。有关的化学方程式为:
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种。请设计实验探究该铁红涂料中添加的物质。
①提出合理假设
假设1:添加了CuO。 假设2:添加了FeO。
②基于假设 (填“1”或“2”),设计实验方案,进行实验。在答题卡上写出实验步骤、预期现象和结论。
限选实验试剂:铁粉、3mol•L-1H2SO4、0.01 mol•L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
|
操作步骤 |
预期现象和结论 |
|
步骤1.取少量样品于试管中,_________________ ____________________________________________ |
___________________________ |
|
步骤2. ____________________________________________ |
___________________________ |
(4)用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸。请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸?(写出计算过程,结果可用数学表达式表示,不必化简)。