题目内容
(8分) 将1.92g铜置入一定量的浓硝酸中,并微热,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当铜反应完毕时(铜片完全消失),共收集到1.12L气体(标准状况),求:
(1)上述过程中,有关反应的化学方程式为 ;
。
(2)反应中被还原的HNO3的物质的量是 mol。
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是多少摩尔?
(8分)(1)Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3= 3Cu(NO3)2+2NO2↑+4H2O (各1分) (2)0.05(2分)
(3)0.015 mol
【解析】考查根据方程式进行的有关计算。
(1)溴水具有强氧化性,应用浓硝酸在反应过程中会逐渐变稀,因此会产生NO气体,有关反应式为Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3= 3Cu(NO3)2+2NO2↑+4H2O。
(2)1.12L气体(标准状况)是NO和NO2的混合气体,物质的量是1.12L÷22.4L/mol=0.05mol。根据氮原子守恒可知,被还原的硝酸是0.05mol。
(3)气体溶于水又生成硝酸,因此原来铜所失去的电子,又被转移到氧气中,因此根据电子的得失守恒可进行计算。
设需参加反应的氧气的物质的量为x,根据电子守恒,可得:
2Cu ~ O2
128g 1mol
1.92g x
128g∶1mol = 1.92g∶x
解得x = (1.92g×1mol)÷128g = 0.015 mol

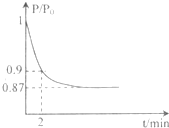 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关. 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,

 )
) 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol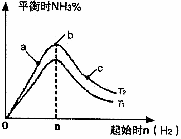

 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
