题目内容
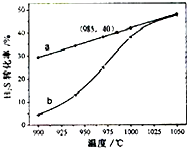 H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )
H2S受热分解的反应为:2H2S(g)→2H2(g)+S2(g).在恒温密闭容器中,控制不同温度进行 H2S分解实验.以H2S起始浓度均为cmol?L-1测定H2S的转化率,结果如图.图中a曲线为H2S 的平衡转化率与温度关系,b曲线表示不同温度下反应经过相同时间的转化率.下列叙述错误的是( )A、985℃时,H2S按上述反应分解的平衡常数K=
| ||
| B、H2S的分解为吸热反应 | ||
| C、图象能解释,温度升高,反应速率加快 | ||
| D、如果只将上述条件中的温度改为压强,图象的形式基本不变 |
分析:A、K为生成物浓度幂之积与反应物浓度幂之积的比;
B、升高温度,化学平衡向着吸热方向进行,据此判断;
C、温度的升高,曲线b向曲线a逼近,反应速率加快;
D、如果增大压强,则化学平衡向着气体系数和减小的方向进行.
B、升高温度,化学平衡向着吸热方向进行,据此判断;
C、温度的升高,曲线b向曲线a逼近,反应速率加快;
D、如果增大压强,则化学平衡向着气体系数和减小的方向进行.
解答:解:A、以H2S起始浓度均为cmol?L-1测定H2S的转化率,985℃时H2S的转化率为40%,则
2H2S(g)→2H2(g)+S2(g).
开始:c 0 0
转化:0.4c 0.4c 0.2c
平衡:0.6c 0.4c 0.2c
K=
=
,故A正确;
B、根据图示内容知道,随着温度的升高,硫化氢的转化率逐渐增大,所以化学平衡正向移动,即化学反应是吸热的,故B正确;
C、温度升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,故C正确;
D、如果增大压强,则化学平衡向着逆反应方向进行,硫化氢的转化率是减小的,和图象不符,故D错误.
故选D.
2H2S(g)→2H2(g)+S2(g).
开始:c 0 0
转化:0.4c 0.4c 0.2c
平衡:0.6c 0.4c 0.2c
K=
| 0.2c×(0.4c)2 |
| (0.6c)2 |
| 0.8c |
| 9 |
B、根据图示内容知道,随着温度的升高,硫化氢的转化率逐渐增大,所以化学平衡正向移动,即化学反应是吸热的,故B正确;
C、温度升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,故C正确;
D、如果增大压强,则化学平衡向着逆反应方向进行,硫化氢的转化率是减小的,和图象不符,故D错误.
故选D.
点评:本题考查学生有关化学反应速率和和化学平衡的有关计算以及化学反应速率和平衡移动的影响因素知识,属于综合知识的考查,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)
无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O) (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题: