题目内容
1.T℃时,某恒荣密闭容器中充入A、B、C三种气体,反应过程中各气体物质的量浓度c(mol/L)随时间的变化如图1所示,C气体的百分含量(C%)随时间、反应条件X的变化如图2所示,下列说法最恰当的是( )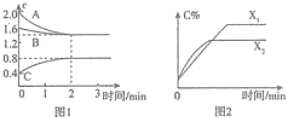
| A. | 0~2分钟、2~3分钟内用A浓度表示的平均反应速率:v(0~2)>v(2~3)>0 | |
| B. | 容器中发生的反应可表示为:3A(g)+B(g)?2C(g) | |
| C. | 若X表示温度,则生成C的反应是放热反应 | |
| D. | 若其他条件不变,仅减小起始时B的浓度,开始反应后C物质的浓度一定减小 |
分析 A、根据图示:2~3分钟的状态是平衡状态;
B、根据物质的量的变化确定反应物和产物,各物质的系数之比等于物质的量浓度的变化量之比,据此回答;
C、根据温度对化学平衡移动的影响知识来回答;
D、减小起始时B的浓度,结合化学平衡的移动方向回答.
解答 解:A、根据图示:2~3分钟的状态是平衡状态,此时物质的浓度不随时间的变化为而变化,无法比较此阶段的反应速率和其他阶段的反应速率关系,故A错误;
B、根据物质的量的变化,确定反应物是A、B,产物是C,各物质的系数之比等于物质的量浓度的变化量之比,即A、B、C的变化量之比是0.6:0.2:0.4=3:1:2,反应为:3A(g)+B(g)?2C(g),故B正确;
C、若X表示温度,线拐先平速率大,所以X2大,升高温度,C%减小,化学平衡逆向移动,所以生成C的反应是放热反应,故C正确;
D、若其他条件不变,仅减小起始时B的浓度,可以根据Qc和K的关系判断反应的方向,开始反应后C物质的浓度不一定减小,故D错误.
故选BC.
点评 本题是一道化学反应速率和化学平衡移动的图象题,考查学生分析和解决问题的能力,难度较大.

练习册系列答案
相关题目
11.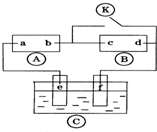 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )
 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
12.下列说法或表示方法正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,一定不能自发进行反应 | |
| B. | 已知:CH4(g)+$\frac{3}{2}$O2(g)═2H2O(l)+CO(g)△H,则△H表示CH4的燃烧热 | |
| C. | 恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)?2C(g),充分反应后测得放出的热量为Q kJ,则该反应的△H=-Q kJ/mol | |
| D. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 |
16.将某些化学知识用图象表示,可以收到直观、简明的效果.下列图象所表示的化学知识中,错误的是( )
| A. |  分散系的分类 | B. | 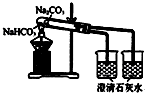 比较Na2CO3、NaHCO3的稳定性 | ||
| C. | 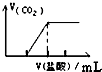 向Na2CO3溶液中逐滴滴入盐酸 | D. | 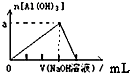 向Al溶液中滴加过量的NaOH溶液 |
13. 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
(1)写出NO与活性炭反应的化学方程式C+2NO?N2+CO2.
(2)上述反应T1℃时的平衡常数K1=4.
(3)上述反应T1℃时达到平衡后,再通入0.1mol的NO的气体,则达到新平衡时NO的转化率为80%.
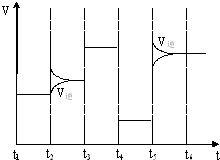
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,
且所改变的条件均不同.已知t3-t4阶段为使用催化剂.请判断温度的高低T1<T2,该反应△H<0.
 车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”.活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:| 物质 T/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
(2)上述反应T1℃时的平衡常数K1=4.
(3)上述反应T1℃时达到平衡后,再通入0.1mol的NO的气体,则达到新平衡时NO的转化率为80%.
(4)如图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,
且所改变的条件均不同.已知t3-t4阶段为使用催化剂.请判断温度的高低T1<T2,该反应△H<0.
10.下列说法正确的是( )
| A. | 盐的组成中一定含有金属元素 | |
| B. | 金属一定能与酸反应产生氢气 | |
| C. | 由同种元素组成的纯净物一定是单质 | |
| D. | 同一化合物里同种元素的化合价一定相同 |
