题目内容
1.某温度下,可逆反应mA(g)+nB(g)?pC(g)的平衡常数为K,下列对K的说法正确的是( )| A. | 如果m+n=p,则K=1 | |
| B. | 若缩小反应器的容积,能使平衡正向移动,则K增大 | |
| C. | 温度越高,K一定越大 | |
| D. | K值越大,表明该反应越有利于C的生成,反应物的转化率越大 |
分析 A.根据该反应的平衡常数K=$\frac{{c}^{p}(C)}{{c}^{m}(A)•{c}^{n}(B)}$判断;
B.化学平衡常数只受温度影响;
C.温度对化学平衡常数的影响与反应的热效应有关,根据热效应判断温度升高平衡移动方向,据此判断升高温度对化学平衡常数的影响;
D.平衡常数越大,说明反应进行的程度越大.
解答 解:A.该反应的平衡常数K=$\frac{{c}^{p}(C)}{{c}^{m}(A)•{c}^{n}(B)}$,m+n=p,K不一定为1,故A错误;
B.化学平衡常数只受温度影响,与浓度无关,若缩小反应器的容积,能使平衡正向移动,温度不变化学平衡常数不变,故B错误;
C.若该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数降低,若正反应为吸热反应,升高温度平衡向正反应移动,平衡常数增大,故C错误;
D.平衡常数越大,说明反应进行的程度越大,反应越有利于C的生成,反应物的转化率越大,故D正确.
故选D.
点评 本题考查了化学平衡的影响因素,为高频考点,题目难度中等,注意掌握化学平衡常数的概念及计算方法,明确影响化学平衡的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
2. 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是( )
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是( )
 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是( )
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是( )| A. | 甲池是b极上析出金属银,乙池是c极上析出某金属 | |
| B. | 甲池是a极上析出金属银,乙池是d极上析出某金属 | |
| C. | 某盐溶液可能是CuSO4溶液 | |
| D. | 某盐溶液可能是Mg(NO3)2溶液 |
9.下列说法不正确的是( )
| A. | 乙烯能使酸性高锰酸钾溶液褪色,发生了氧化反应 | |
| B. | 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应 | |
| C. | 邻二氯苯不存在同分异构体说明了苯不存在单双键交替的结构 | |
| D. | 1mol甲烷和1mol氯气在光照条件下发生反应,产物只有CH3Cl和HCl |
13.氮的化合物既是一种资源,也会给环境造成危害.
I.氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O(g),△H=-x KJ/mol (x>0),其他相关数据如表:
则表中z(用x a b d表示)的大小为x-d+b+2a.
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应到达平衡时CO2的平均反应速率为0.00417mol/(L•s),此温度时的平衡常数为8.

下列能使正反应的化学反应速率加快的措施有②③.
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境.目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质.某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体).
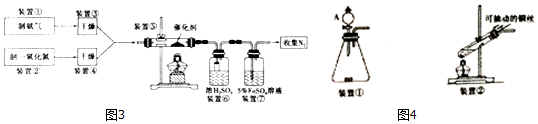
(l)写出装置⑤中反应的化学方程式4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
(2)装置①和装置②如图4,仪器A的名称为分液漏斗,其中盛放的药品名称为浓氨水.
装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化.
(3)装置⑥中,小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是溶液变浑浊.
I.氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O(g),△H=-x KJ/mol (x>0),其他相关数据如表:
| 物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应到达平衡时CO2的平均反应速率为0.00417mol/(L•s),此温度时的平衡常数为8.

下列能使正反应的化学反应速率加快的措施有②③.
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境.目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质.某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体).

(l)写出装置⑤中反应的化学方程式4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
(2)装置①和装置②如图4,仪器A的名称为分液漏斗,其中盛放的药品名称为浓氨水.
装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化.
(3)装置⑥中,小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是溶液变浑浊.
10.下列有关化学反应速率的说法中正确的是( )
| A. | 实验室制氢气时,加入少量NaNO3固体,不影响反应速率 | |
| B. | 锌片分别与c(H+)相等的醋酸、硫酸反应,平均反应速率相等 | |
| C. | 升高温度后,吸热反应的速率加快,放热反应的速率减慢 | |
| D. | 纳米铁粉在空气中自燃,是因为纳米铁粉的表面积大 |
 已知某粒子的结构示意图如图.试回答:
已知某粒子的结构示意图如图.试回答: 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O
+3H2O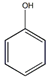 +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr