题目内容
高温超导材料富勒烯化合物是当前研究的热点物质.
(1)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图1所示.该富勒烯化合物中的化学式为 .
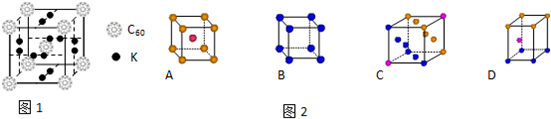
(2)如图2,金属钾采用的是下列 (填字母代号)堆积方式,每个钾原子的配位数是 .
(3)金刚石中的C-C的键长为154pm,C60中C-C键长为140~145pm.有同学据此推断C60的熔点高于金刚石,你认为是否正确并阐述理由: .
(1)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图1所示.该富勒烯化合物中的化学式为

(2)如图2,金属钾采用的是下列
(3)金刚石中的C-C的键长为154pm,C60中C-C键长为140~145pm.有同学据此推断C60的熔点高于金刚石,你认为是否正确并阐述理由:
考点:晶胞的计算
专题:化学键与晶体结构
分析:(1)利用均摊法确定K原子和C60分子的个数比,进而确定化学式;
(2)钾是体心立方堆积,其配位数是8,据此答题;
(3)物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体.
(2)钾是体心立方堆积,其配位数是8,据此答题;
(3)物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体.
解答:
解:(1)该晶胞中C60个数=1+8×
=2,6×2×
=6,所以K原子和C60分子的个数比为6:2=3:1,所以化学式为:K3C60,故答案为:K3C60;
(2)钾是体心立方堆积,其配位数是8,故选A;8;
(3)原子晶体的熔点大于分子晶体,金刚石是原子晶体,C60是分子晶体,物质的熔点与键长无关,所以该说法错误,
故答案为:错误,因为金刚石是原子晶体,熔化时克服的是共价键,而C60是分子晶体,熔化时克服的是分子间的作用力.
| 1 |
| 8 |
| 1 |
| 2 |
(2)钾是体心立方堆积,其配位数是8,故选A;8;
(3)原子晶体的熔点大于分子晶体,金刚石是原子晶体,C60是分子晶体,物质的熔点与键长无关,所以该说法错误,
故答案为:错误,因为金刚石是原子晶体,熔化时克服的是共价键,而C60是分子晶体,熔化时克服的是分子间的作用力.
点评:本题考查了物质结构和性质,涉及晶胞的结构、晶胞的计算、分子间作用力等知识点,难度不大,离子配位数的判断是学习难点,要会运用均摊法计算化学键、晶胞的化学式等.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的物质的量浓度为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
 科学家发现铂的两种化合物a和b,实验测得a和b具有不同的特性.a具有抗癌作用,而b没有,则下列关于a、b的叙述正确的是( )
科学家发现铂的两种化合物a和b,实验测得a和b具有不同的特性.a具有抗癌作用,而b没有,则下列关于a、b的叙述正确的是( )| A、a和b属于同一种物质 |
| B、a和b互为同分异构体 |
| C、a和b属于手性异构体 |
| D、a和b的空间构型是四面体 |
关于反应N2+3H2
2NH3的说法错误的是( )
| 催化剂 |
| △ |
| A、外界条件可以改变平衡状态 |
| B、达到平衡时正、逆反应速率相等 |
| C、平衡时各组分的浓度相等 |
| D、该反应所建立的平衡是动态平衡 |
 自然界中存在大量的金属元素,其中钠、镁、铁、铜等在工农业生产中有着广泛的应用.
自然界中存在大量的金属元素,其中钠、镁、铁、铜等在工农业生产中有着广泛的应用.