题目内容
16.现有CH4、C2H4、C6H6三种有机物:(1)等质量的三种气体完全燃烧时生成水最多的是CH4;
(2)同状况、同体积的三种气体完全燃烧时耗去O2的量最多的是C2H6.
(3)在150℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是CH4、C2H4.
(4)某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将44.8L混合气体通入足量溴水,溴水质量增重28.0g.混合气体中气态烷烃的化学式CH4;混合气体中两种气体的物质的量之比n(CH4):n(烯烃)=3:1.
分析 (1)等质量烃完全燃烧,H元素的质量分数越大,耗氧量越大;
(2)同状况、同体积的三种气体,其物质的量相等,等物质的量的烃CxHy完全燃烧时,(x+$\frac{y}{4}$)的值越大,耗氧量越大;
(3)在150℃、1.01x105Pa时,烃燃烧生成的水是气态,令烃的平均组成CxHy,根据燃烧反应前后气体体积没有变化,则反应前后气体的化学计量数之和相等;
(4)相同条件下,密度之比等于相对分子质量之比,则混合气体的平均相对分子质量为13×2=26,故一定含有甲烷,计算44.8L混合气体的物质的量,再根据m=nM计算混合气体的质量,溴水质量增重28g为烯烃的质量,进而计算烷烃的质量与物质的量,再计算烯烃的物质的量.
解答 解:(1)等质量的烃CxHy完全燃烧时,氢元素的质量分数越大,耗氧量越大,CH4、C2H4、C2H6中的y:x值依次为4、2、3,故CH4中H元素质量分数最大,故甲烷消耗O2最多,
故答案为:CH4;
(2)同状况、同体积的三种气体,其物质的量相等,等物质的量的烃CxHy完全燃烧时,(x+$\frac{y}{4}$)的值越大,耗氧量越大,CH4、C2H4、C2H6的(x+$\frac{y}{4}$)值依次为1+$\frac{4}{4}$=2、2+$\frac{4}{4}$=3、2+$\frac{6}{4}$=3.5,故C2H6消耗O2最多,
故答案为:C2H6;
(3)在150℃、1.01x105Pa时,烃燃烧生成的水是气态,令烃的平均组成CxHy,则:CxHy+(x+$\frac{y}{4}$)O2=xCO2+$\frac{y}{2}$H2O(g),燃烧反应前后气体体积没有变化,则反应前后气体的化学计量数之和相等,故1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,解得y=4,即满足H原子数目为4即可,故为CH4、C2H4,
故答案为:CH4、C2H4;
(4)在同温同压下,混合气体对氢气的相对密度为13,故混合气体的平均相对分子质量为13×2=26,故一定含有甲烷,标况下44.8L混合气体的物质的量为$\frac{44.8L}{22.4L/mol}$=2mol,故混合气体的总质量为2mol×26g/mol=52g,溴水质量增重28g为烯烃的质量,故甲烷的质量为52g-28g=24g,故甲烷的物质的量为$\frac{24g}{16g/mol}$=1.5mol烯烃的物质的量为2mol-1.5mol=0.5mol,故n(CH4):n(烯烃)=1.5mol:0.5mol=3:1,
故答案为:CH4;n(CH4):n(烯烃)=3:1.
点评 本题考查烃燃烧的有关计算、混合物有关计算,侧重考查学生分析和解决问题的能力,注意对规律的理解掌握,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | F-的结构示意图: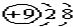 | |
| B. | 乙烷和丙烯互为同系物 | |
| C. | NaCl的电子式:Na${\;}_{×}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$ | |
| D. | H2、D2、T2属于同位素,化学性质几乎完全相同 |
 ,该有机物的分子式为( )
,该有机物的分子式为( )| A. | C14H24O2 | B. | C15H23O2 | C. | C16H24O2 | D. | C15H24O2 |
| A. | S2- | B. | HCO3- | C. | Al3+ | D. | Fe2+ |
| A. | 固态氢 | B. | 固态氖 | C. | 白磷 | D. | 三氧化硫 |
| A. | 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成的硫酸钡沉淀的质量比为1:2:3,则三种硫酸盐溶液的物质的量浓度比为1:2:3 | |
| B. | 150 mL 1mol•L-1的氯化钾溶液中的c(Cl-)与50 mL 1 mol•L-1的氯化铝溶液中的c(Cl-) 相等 | |
| C. | 20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl 的质量分数为25.38% | |
| D. | 20℃时,100 g水可溶解34.2g KCl,此时KCl饱和溶液的质量分数为34.2% |
| A. | 氯化铝溶液中加入过量氨水的过程中,先有沉淀后又溶解 | |
| B. | 若某反应的反应物的总能量大于生成物的总能量,则该反应为放热反应 | |
| C. | 少量的氯气在加热时与过量的铁反应可以生成氯化亚铁 | |
| D. | 非金属氧化物一定是酸性氧化物 |
 实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol•L-1 NaOH溶液450mL和0.5mol•L-1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: