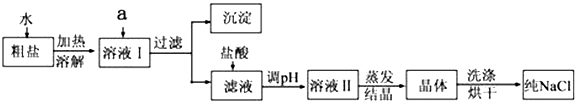
题目内容
【题目】W、X、Y、Z是原子序数依次增大的四种短周期元素.W的气态氢化物能使紫色石蕊溶液变蓝,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,W、X、Y、Z的最外层电子数之和为16.
(1)W单质的电子式是 .
(2)请用化学用语解释W的气态氢化物能使紫色石蕊溶液变蓝的原因: .
(3)已知As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是 .
(4)W的最高价氧化物的水化物与Y的氢氧化物发生反应的离子方程式是
(5)X与Z的单质之间发生反应的化学方程式是 .
(6)已知Q与Z是位于相邻周期的同主族元素.某温度下,两种元素的气态单质与H2发生化合反应生成气态氢化物的平衡常数分别为KQ=5.6×107 , KZ=9.7×1012 . Q的元素符号是 , 理由是 .
【答案】
(1)![]()
(2)NH3+H2O ![]() ?NH3?H2O
?NH3?H2O ![]() ?NH4++OH﹣
?NH4++OH﹣
(3)第四周期 第VA族
(4)3H++Al(OH)3═Al3++3H2O
(5)2Na+Cl2 ![]() 2NaCl
2NaCl
(6)Br;由KQ<KZ可知Q的气态氢化物的稳定性弱于Z,故Q的非金属性弱于Z
【解析】解:W、X、Y、Z是原子序数依次增大的四种短周期元素.W的气态氢化物能使紫色石蕊溶液变蓝,则W为N元素,W和X两种元素的最高价氧化物的水化物均能与Y的氢氧化物发生反应,应是氢氧化铝与强酸、强碱之间的反应,可以推断X为Na、Y为Al.由于W、X、Y、Z的最外层电子数之和为16,可知Z原子最外层电子数为16﹣5﹣1﹣3=7,由原子序数知Z处于第三周期,故Z为Cl.(1)W单质为N2 , 其电子式是 ![]() ,所以答案是:
,所以答案是: ![]() (2)W的气态氢化物能使紫色石蕊溶液变蓝的原因:NH3+H2O
(2)W的气态氢化物能使紫色石蕊溶液变蓝的原因:NH3+H2O ![]() NH3H2O
NH3H2O ![]() NH4++OH﹣ , 所以答案是:NH3+H2O
NH4++OH﹣ , 所以答案是:NH3+H2O ![]() NH3H2O
NH3H2O ![]() NH4++OH﹣;(3)As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是:第四周期 第VA族,
NH4++OH﹣;(3)As元素的原子序数为33,与W在同一主族,As在元素周期表中的位置是:第四周期 第VA族,
所以答案是:第四周期 第VA族;(4)W的最高价氧化物的水化物为HNO3 , Y的氢氧化物为Al(OH)3 , 二者发生反应的离子方程式是:3H++Al(OH)3═Al3++3H2O,
所以答案是:3H++Al(OH)3═Al3++3H2O(5)X与Z的单质之间发生的反应是钠在氯气中燃烧生成氯化钠,反应的化学方程式是:2Na+Cl2 ![]() 2NaCl,
2NaCl,
所以答案是:2Na+Cl2 ![]() 2NaCl;(6)已知Q与Z(Cl))是位于相邻周期的同主族元素,则Q为Br,由KQ<KZ可知Q的气态氢化物的稳定性弱于Z,故Q的非金属性弱于Z,
2NaCl;(6)已知Q与Z(Cl))是位于相邻周期的同主族元素,则Q为Br,由KQ<KZ可知Q的气态氢化物的稳定性弱于Z,故Q的非金属性弱于Z,
所以答案是:Br;由KQ<KZ可知Q的气态氢化物的稳定性弱于Z,故Q的非金属性弱于Z.

【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点.
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)CH4(g)+2H2O(g)
已知H2的体积分数随温度的升高而增加.
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化.(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/molL﹣1 | [H2]/molL﹣1 | [CH4]/molL﹣1 | [H2O]/molL﹣1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为 .
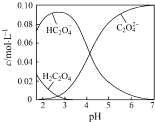
(3)碳酸:H2CO3 , Ki1=4.3×10﹣7 , Ki2=5.6×10﹣11
草酸:H2C2O4 , Ki1=5.9×10﹣2 , Ki2=6.4×10﹣5
0.1mol/LNa2CO3溶液的pH0.1mol/LNa2C2O4溶液的pH.(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是 . 若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是 . (选填编号)
a.[H+]>[HC2O4﹣]>[HCO3﹣]>[CO32﹣] b.[HCO3﹣]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣]
c.[H+]>[HC2O4﹣]>[C2O42﹣]>[CO32﹣] d.[H2CO3]>[HCO3﹣]>[HC2O4﹣]>[CO32﹣]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++HCO3﹣H2CO3 , 当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象.
【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL﹣1 | 溶液的密度/gcm﹣3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |

(1)表中硫酸的质量分数为(不写单位,用含c1、ρ1 , 的代数式表示).
(2)物质的量浓度为c1molL﹣1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为molL﹣1 .
(3)将物质的量浓度分别为c2molL﹣1和 ![]() c2molL﹣1的氨水等质量混合,所得溶液的密度(填“大于”、“小于”或“等于”,下同)ρ2gcm﹣3 , 所得溶液的物质的量浓度
c2molL﹣1的氨水等质量混合,所得溶液的密度(填“大于”、“小于”或“等于”,下同)ρ2gcm﹣3 , 所得溶液的物质的量浓度 ![]() c2molL﹣1(设混合后溶液的体积变化忽略不计)
c2molL﹣1(设混合后溶液的体积变化忽略不计)