题目内容
下列离子方程式书写正确的是
- A.NaClO溶液中通入少量的SO2气体:2ClO-+SO2+H2O=SO
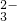 +2HClO
+2HClO - B.铜跟浓硝酸反应:3Cu+8H++2NO
 =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O - C.向Ca(HCO3)2溶液中滴加过量NaOH溶液:Ca2++2HCO
 +2OH-=CaCO3↓+CO
+2OH-=CaCO3↓+CO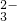 +2H2O
+2H2O - D.MgSO4溶液跟Ba(OH)2溶液反应:SO
 +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
C
分析:A.发生氧化还原反应生成硫酸钠;
B.反应生成硝酸铜、二氧化氮、水;
C.Ca(HCO3)2完全反应,生成碳酸钙、碳酸钠、水;
D.漏写生成氢氧化镁的离子反应.
解答:A.NaClO溶液中通入少量的SO2气体的离子反应为ClO-+SO2+H2O=SO42-+2H++Cl-,故A错误;
B.铜跟浓硝酸反应的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故B错误;
C.向Ca(HCO3)2溶液中滴加过量NaOH溶液的离子反应为Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故C正确;
D.MgSO4溶液跟Ba(OH)2溶液反应的离子反应为Mg2++2OH-+SO42-+Ba2+=BaSO4↓+Mg(OH)2↓,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意与量有关的离子反应为解答的难点,题目难度不大.
分析:A.发生氧化还原反应生成硫酸钠;
B.反应生成硝酸铜、二氧化氮、水;
C.Ca(HCO3)2完全反应,生成碳酸钙、碳酸钠、水;
D.漏写生成氢氧化镁的离子反应.
解答:A.NaClO溶液中通入少量的SO2气体的离子反应为ClO-+SO2+H2O=SO42-+2H++Cl-,故A错误;
B.铜跟浓硝酸反应的离子反应为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故B错误;
C.向Ca(HCO3)2溶液中滴加过量NaOH溶液的离子反应为Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故C正确;
D.MgSO4溶液跟Ba(OH)2溶液反应的离子反应为Mg2++2OH-+SO42-+Ba2+=BaSO4↓+Mg(OH)2↓,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意与量有关的离子反应为解答的难点,题目难度不大.

练习册系列答案
相关题目
下图是元素周期表的框架,请在表中①~⑩元素中回答问题
| ① | | | |||||||||||||||
| | | | | | ② | ③ | ④ | | |||||||||
| ⑤ | ⑥ | ⑦ | | | | ⑧ | | ||||||||||
| ⑨ | | | | | | | | | | | | | | | | ⑩ | |
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为__________________________。
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为_______________________。
(3)⑧与⑩两种元素非金属较强的是________,请用一个离子方程式证明该结论_________。
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式_____________________,电池工作时阴离子定向移动到________极(填正或负)。
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为____________kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |