题目内容
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比, ClO2不但具有更显著的杀菌能力, 而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2 的制备方法中, 有下列两种常用制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为__________________,其中方法二制备的ClO2 更适合用于饮用水的消毒, 其主要原因是 。
(2)我国最近成功研制出制取ClO2 的新方法, 其反应的微观过程如图甲所示:
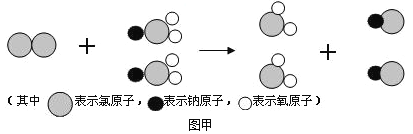
该反应的化学方程式为 。
(3)消毒时, ClO2对污水中Fe2+、Mn2+、S2-和CN— 等有明显的去除效果.某工厂污水中含CN—,现用ClO2将CN—氧化,生成两种无毒气体,其离子反应方程式为 。
(4)自来水厂用ClO2 处理后的水中, 要求ClO2 的浓度在0. 1~0. 8mg/L之间。碘量法可以检测水中ClO2 的浓度,步骤如下:
Ⅰ. 取一定体积的水样用氢氧化钠溶液调至中性, 然后加入一定量的碘化钾, 并加入淀粉溶液, 溶液变蓝。
Ⅱ. 加入一定量的Na2S2O3 溶液。(已知: 2S2O32- +I2 =S4O62- +2I - )
Ⅲ. 重复上述操作2~3次。
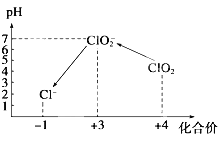
操作时, 不同pH环境中粒子种类如上图所示:
请回答:
①操作Ⅰ中反应的离子方程式是 ;
②确定操作Ⅱ恰好完全反应的现象是 ;
③若水样的体积为1. 0 L, 在操作Ⅱ时消耗了1. 0×10 -3 mol/L的Na 2 S 2 O 3 溶液10 mL, 则水样中ClO2 的浓度是 mg/L。
【答案】
(1)1:1 方法二制备的ClO2中不含Cl2
(2)Cl2+2NaClO2=2NaCl+2ClO2
(3)2ClO2+2CN-=N2↑+2CO2↑+2Cl-
(4)①2ClO2+2I-=2ClO2-+I2
②锥形瓶溶液由蓝色变为无色,且半分钟不复原 ③0.675
【解析】
试题分析:(1)在方法一中,2NaClO3 +4HCl = 2ClO2 ↑+Cl2↑+2NaCl+2H2O,NaClO3中Cl元素化合价由+5价降低到+4价,作氧化剂,HCl中有一半Cl元素由-1价升高到0价,作还原剂,则氧化剂与还原剂的物质的量之比为2:2=1:1;方法二中制备的ClO2中不含Cl2 ,所以方法二制备的ClO2 更适合用于饮用水的消毒。
(2)根据反应的微观过程示意图可写出该反应的化学方程式为Cl2+2NaClO2=2NaCl+2ClO2 。
(3)用ClO2将CN—氧化,生成两种无毒气体,该气体为氮气和二氧化碳,根据得失电子守恒、电荷守恒和原子守恒配平,离子反应方程式为2ClO2+2CN-=N2↑+ 2CO2↑+2Cl-。
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2- + I2 ;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,蓝色会消失,所以确定操作Ⅱ恰好完全反应的现象是锥形瓶溶液由蓝色变为无色,且半分钟不复原;
③由化学反应得关系式:
S2O32-~I-~ClO2
1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mgmol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为0.675mg÷1L=0.675 mgL-1。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案
