题目内容
13.下列化学方程式中.对电子转移情况分析不正确的是( )| A. |  | B. |  | ||
| C. |  | D. | 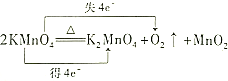 |
分析 在氧化还原反应中,元素化合价降低值=元素原子得电子的数目=元素化合价升高值=元素原子失电子的数目=转移电子数,以此解答该题.
解答 解:A.反应中Zn元素化合价由0价变化为+2价,失去2个电子,H元素化合价由+1价降低到0价,得到2个电子,故A正确;
B.反应中Fe元素化合价由+3价降低到0价,共得到6个电子,C元素化合价由+2价升高到+4价,共失去6个电子,故B正确;
C.反应中Cl元素化合价由+5价降低到-1价,共得到12个电子,O元素化合价由-2价升高到0价,共失去12个电子,故C正确;
D.反应中Mn元素化合价由+7价分别降低到+4、+6价,共得到4个电子,O元素化合价由-2价升高到0价,共失去4个电子,故D错误.
故选D.
点评 本题考查学生氧化还原反应中,化合价变化和电子转移之间的关系知识,注意规律:元素化合价降低值=元素原子得电子的数目=元素化合价升高值=元素原子失电子的数目=转移电子数的应用是关键,易错点为D,注意Mn元素化合价的变化,难度不大.

练习册系列答案
相关题目
4.下列物质中属于单质的是( )
| A. | 水 | B. | 水煤气 | C. | 氧气 | D. | 二氧化碳 |
1.下列说法不正确的是( )
| A. | 在指定状态下各物质的焓值都是确定且是唯一的 | |
| B. | 当同一个化学反应以不同的过程完成时,反应的焓变是不同的 | |
| C. | 如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变为相关化学反应的焓变的代数和 | |
| D. | 对于一个化学反应,无论经过哪些步骤从反应物变成生成物,反应的焓变是一样的 |
11.从防止污染、减少用酸量之可持续发展的角度分析,下列利用金属铜制取Cu(NO3)2的方法中最好的是( )
| A. | Cu$\stackrel{浓HNO_{3}}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀HNO_{3}}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{Ot}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:

 B(OH)4-+H+;
B(OH)4-+H+;