题目内容
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
(1)该反应的化学方程式为________,生成物NF3中氮原子的杂化方式为________,NF3分子空间构型为________;
(2)N、F两种元素的氢化物稳定性比较,NH3________HF(选填“>”或“<”);
(3)N3-被称为类卤离子,写出1种与N3-互为等电子体的分子的化学式________;
(4)元素A基态原子的核外电子排布式为
1s22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如图,该离子化合物的化学式为________.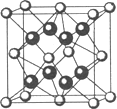
答案:
解析:
解析:
|
(1)3F2+4NH3 (2)<(2分) (3)N2O或CO2(2分) (4)CaF2(2分) |

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2===NF3+3NH4F。在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3。下列说法正确的是( )
| A.制取NF3的反应中,氧化剂与还原剂的物质的量之比为3∶1 |
| B.在NF3与H2O的反应中,H2O作还原剂 |
| C.若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol |
| D.NF3在空气中一旦泄漏,不易于发现 |