��Ŀ����
����Ŀ��1902��¹���ѧ�ҹ����о����ϳɰ��ķ�����
��1��ij�¶�ʱ��N2��H2��Ӧ�����淴Ӧ�������е������仯��ͼ1��ʾ�� 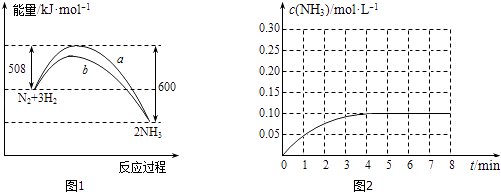
��д���ϳɰ����Ȼ�ѧ����ʽ ��
������������ȷ���� ��
A��b�����Ǽ������ʱ�������仯����
B�����ܱ������м���28gN2��6gH2 �� ��ַ�Ӧ�ų�������С��92kJ
C����ͼ��֪���Ͽ�1molN��N����3molH��H�����յ�������С���γ�6molN����������ų�������
D����Ӧ������������������������
��2����һ�ݻ�Ϊ4L���ܱ������У�����0.4molN2��1.2molH2 �� ��һ�������·�����Ӧ����Ӧ��NH3�����ʵ���Ũ�ȱ仯�����ͼ2��ʾ����ͼ����ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ������H2��Ϊmol/��Lmin����ƽ��ʱ��c��N2��Ϊ ��
��3��������֤ʵN2��H2�ڹ��������Fe�����������ͽ����Ժϳɰ��Ĺ��̶���ŵ������������ ![]() �ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿�����ͼ��ʾ������������״̬��ߵ���������ĸ��ţ���
�ֱ��ʾN2��H2��NH3������������ڹ����������ϳɰ��Ĺ��̿�����ͼ��ʾ������������״̬��ߵ���������ĸ��ţ��� 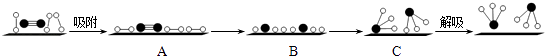
���𰸡�
��1��N2��g��+3H2��g��?2NH3��g����H=��92KJ/mol��abc
��2��0.0375��0.05mol/L
��3��B
���������⣺��1���١�H=�ų������������յ�����=508KJ/mol��600KJ/mol=��92KJ/mol�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��2NH3��g����H=��92KJ/mol��
���Դ��ǣ�N2��g��+3H2��g��2NH3��g����H=��92KJ/mol����A��ʹ�ô����ܽ������淴Ӧ�Ļ�ܣ������ܸı䷴Ӧ����ЧӦ����b�����Ǽ������ʱ�������仯���ߣ���a��ȷ��B�����ںϳɰ��ķ�ӦΪ���淴Ӧ�����ܽ��г��ף������ܱ������м���28gN2��6gH2 �� ��ַ�Ӧ�ų�������С��92kJ����b��ȷ��C����ͼ��֪���Ͽ�1molN��N����3molH��H�����յ�������Ϊ508KJ��С���γ�6molN����������ų�������600KJ����c��ȷ��D����ͼ��֪����Ӧ����������������������������Ӧ���ȣ���d����ѡabc����2������ͼ�����ƽ��ʱ������Ũ��Ϊ0.1mol/L��ʱ��Ϊ4min��������������֮�ȵ���ϵ��֮�ȵõ���v��H2��=v��NH3��= ![]() ��
�� ![]() =0.0375 mol/��Lmin����ƽ��ʱ������Ũ��Ϊ0.1mol/L������c��NH3��=0.1mol/L����Ũ�ȵĸñ���֮�ȵ��ڼ�����֮�ȣ��ʡ�c��N2��=0.05mol/L���������ij�ʼŨ��Ϊ0.1mol/L����ƽ��ʱ��c��N2��Ϊ0.05mol/L�����Դ��ǣ�0.0375��0.05mol/L����3�����ڻ�ѧ���Ķ���Ҫ�����������ʻ״̬B���������ڳ�ʼ״̬A�����������˷�ӦΪ���ȷ�Ӧ���ʳ�ʼ״̬A����������ĩ̬C����������B��������ߣ�
=0.0375 mol/��Lmin����ƽ��ʱ������Ũ��Ϊ0.1mol/L������c��NH3��=0.1mol/L����Ũ�ȵĸñ���֮�ȵ��ڼ�����֮�ȣ��ʡ�c��N2��=0.05mol/L���������ij�ʼŨ��Ϊ0.1mol/L����ƽ��ʱ��c��N2��Ϊ0.05mol/L�����Դ��ǣ�0.0375��0.05mol/L����3�����ڻ�ѧ���Ķ���Ҫ�����������ʻ״̬B���������ڳ�ʼ״̬A�����������˷�ӦΪ���ȷ�Ӧ���ʳ�ʼ״̬A����������ĩ̬C����������B��������ߣ�
���Դ��ǣ�B��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���¶�ΪT1ʱ���������ݻ���Ϊ1 L�ĺ����ܱ������н�������Ӧ: 2NO2(g)![]() 2NO(g)+O2(g) (����Ӧ����)��ʵ����:v��=v(NO2)����=k��c2(NO2)��v��=v(NO)����= 2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
2NO(g)+O2(g) (����Ӧ����)��ʵ����:v��=v(NO2)����=k��c2(NO2)��v��=v(NO)����= 2v(O2)����=k��c2(NO)��c(O2)��k����k��Ϊ���ʳ��������¶�Ӱ�졣����˵����ȷ����
������� | ���ʵ���ʼŨ��(mol/L) | ���ʵ�ƽ��Ũ��(mol/L) | ||
c (NO2) | c (NO) | c (O2) | c(O2) | |
�� | 0.6 | 0 | 0 | 0.2 |
�� | 0.3 | 0.5 | 0.2 | |
�� | 0 | 0.5 | 0.35 | |
A. ��ƽ��ʱ�����������������е���ѹǿ֮��Ϊ4��5
B. ��ƽ��ʱ����������c(O2)/ c(NO2)���������еĴ�
C. ��ƽ��ʱ����������NO���������С��50%
D. ���¶ȸı�ΪT2ʱ����k��=k������T2>T1


