题目内容
某同学用25℃的水溶解一定量的NaCl,充分搅拌后发现杯底还有部分NaCl晶体没有溶解。然后该同学又用酒精灯加热至60℃,固体全部溶解。则在加热前后,以下各量没有发生改变的是
- A.NaCl的溶解度
- B.溶质的质量
- C.溶剂的质量
- D.溶质的质量分数
氯化钠的溶解度随温度的升高而增大,A不正确。随着氯化钠的溶解,溶质的质量增加,B不正确。在加热过程中,溶剂是不变,C正确。溶剂不变,但溶质是增加的,因此质量分数是增加的,D不正确,答案选C。

(12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图: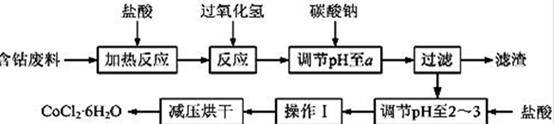
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为

 。
。(2)加入碳酸钠调节pH至a,a的范围是 ;
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写1点)。
芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸 。反应原理:

反应试剂、产物的物理常数:
名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:

图1回流搅拌装置 ???? ???????????????? 图2抽滤装置
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

(1)仪器K的名称为????? 。无色液体A的结构简式为????? 。操作Ⅱ为????? 。
如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是????? 。
(3)下列关于仪器的组装或者使用正确的是????? 。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入????? ,分液,水层再加入????? ,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为????? 。
CoCl2?6H2O是一种饲料营养强化剂.以含钴(Co)废料(含少量Fe、Al等杂质)制取CoCl2?6H2O的一种新工艺,流程如图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2?6H2o熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.0 | 9.7 | 9.2 | 5.2 |
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为______.
(2)加入碳酸钠调节pH至a,a的范围是______.
(3)操作I包含3个基本实验操作,它们是______和过滤.
(4)制得的CoCl2?6H2O需减压烘干的原因是______.
(5)为测定产品中CoCl2?6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2?6H2O的质量分数大于100%,其原因可能是______.
(6)在实验室中,为了从上述产品中获得纯净的CoCl2?6H2O,采用的方法是______.

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2?6H2o熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.0 | 9.7 | 9.2 | 5.2 |
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为______.
(2)加入碳酸钠调节pH至a,a的范围是______.
(3)操作I包含3个基本实验操作,它们是______和过滤.
(4)制得的CoCl2?6H2O需减压烘干的原因是______.
(5)为测定产品中CoCl2?6H2O的含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2?6H2O的质量分数大于100%,其原因可能是______.
(6)在实验室中,为了从上述产品中获得纯净的CoCl2?6H2O,采用的方法是______.

 。
。