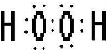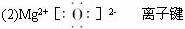题目内容
由某元素X构成的气态双原子分子有三种分子量,分别为70、72、74.该气体中三种分子(与分子量对应)的物质的量之比为9∶6∶1.试确定:
(1)X元素有几种同位素,质量数分别是多少?
(2)各同位素的原子百分比是多少?
(3)X元素的原子量.
答案:略
解析:
解析:
|
(1)X有两种同位素,设为  和 和 (令a<b),三种双原子分子为: (令a<b),三种双原子分子为: 、 、 、 、 . .
∵ a<b,∴分子量  2a=70 a=35, 2a=70 a=35,
 2b=74 b=37. 2b=74 b=37.
(2)方法一;若共有16mol  ,则其中含 ,则其中含 、 、 ∶、 ∶、 . .


 占的百分比为: 占的百分比为: , , 占的百分比为25%. 占的百分比为25%.
方法二:对双原子分子,平均原子量 =平均分子式量/2,该 气体可看成是上述三种分子混合而成. 气体可看成是上述三种分子混合而成.
设  的百分比为x,则 的百分比为x,则 为1-x,有 为1-x,有
∴ x=0.75=75%
 占的百分比为:1-75%=25% 占的百分比为:1-75%=25%
(3)元素X的原子量即为  、 、 两种同位素原子量的平均值——平均原子量为:35×75%+37×25%=35.5. 两种同位素原子量的平均值——平均原子量为:35×75%+37×25%=35.5.
分子是由原子构成的,由于同种元素含有不同种的原子,因而同类分子也含有不同种的分子 (分子量不同、原子比相同).那么三种双原子分子是由几种同位素构成呢?我们知道H有三种同位素 、 、 、 、 ,由它们构成的 ,由它们构成的 应该是6种.由上述推导过程可以看出,X元素应该有两种同位素. 应该是6种.由上述推导过程可以看出,X元素应该有两种同位素. |

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目