题目内容
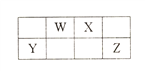
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为18。下列叙述正确的是
A. 氢化物的沸点:X<Z
B. 简单离子的半径:Y<X
C. 最高价氧化物对应水化物的酸性:Y>W
D. W与氢形成的所有化合物中的化学键均为极性共价键
【答案】B
【解析】由元素在周期表中的位置可知,W、X为第二周期,Y、Z为第三周期,设Y的最外层电子数为n,则W的最外层电子数为n+1、X的最外层电子数为n+2、Z的最外层电子数为n+3,则n+n+1+n+2+n+3=18,解得n=3,则Y为Al元素,W为N元素,X为O元素,Z为Cl元素,A.X为O元素,对应的氢化物分子之间可形成氢键,沸点比HCl高,即沸点:X>Z,A错误;N.X为O、Y为Al,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,则简单离子的半径:Y<X,B正确;C.Y为Al,对应的氧化物的水化物为两性氢氧化物,W为N,对应的氧化物的水化物溶液呈酸性,则氧化物对应水化物的酸性:Y<W,C错误;D.氮与氢形成的所有化合物中的化学键可能含有非极性共价键,例如N2H4等,D错误;答案选B。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】少量杂质(括号内为杂质),选用试剂和分离方法能达到实验目的的是
混合物 | 试剂 | 分离方法 | |
A | 乙烷(乙烯) | (H+)KMnO4 | 洗气 |
B | 乙醇(H2O) | 新制CaO | 蒸馏 |
C | 苯(苯酚) | 溴水 | 过滤 |
D | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
A. A B. B C. C D. D
【题目】(12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
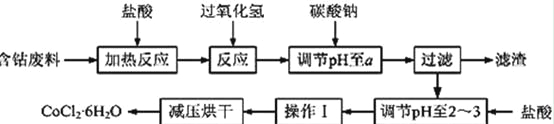
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 。
(2)加入碳酸钠调节pH至a,a的范围是 ;
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写1点)。