题目内容
[化学——化学与技术] (15分)
硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 的郊区(填标号);
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
(3)为提高SO3吸收率,实际生产中通常用 吸收SO3。
(4)已知反应2SO2+O2
 2SO3 △H <0,现将0.050mol SO2和0.030mol O2充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO 2的转化率为________;该条件下的平衡常数为__________。
2SO3 △H <0,现将0.050mol SO2和0.030mol O2充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO 2的转化率为________;该条件下的平衡常数为__________。(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
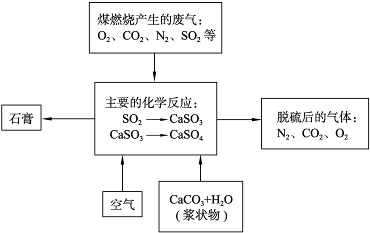
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式 。
(1)C(1分) (2)4CuFeS2+13O2 4CuO+2Fe2O3+8SO2(2分)
4CuO+2Fe2O3+8SO2(2分)
(3)98%的浓硫酸(1分)
(4)80% (2分)
1.6×103(2分)
(5)SO2转化为SO3是正反应放热的可逆反应(1分),随温度升高,平衡左移,SO3物质的量减少(1分),所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少)
(6)石灰水(1分);SO2+Ca(OH)2==CaSO3↓+H2O (2分)
CaSO3+H2SO4==CaSO4+SO2↑+H2O (2分)
解析

练习册系列答案
相关题目
【化学-化学与技术】某强酸性工业废水中含有Fe2+、Fe3+、Cu2+,设计实验方案用沉淀法除去铁离子,得到较纯的Cu2+溶液.有关氢氧化物沉淀的pH如下表:
(1)从表中数据分析,为什么不能直接加NaOH将溶液pH调到9.7来除去Fe3+和Fe2+ .
(2)实际应用中则是先加一定量的次氯酸钠,然后再调节溶液pH.次氯酸钠的作用是 .
(3)pH应调节到什么范围 ,为什么 .
(4)调节pH适宜的试剂是
A.氢氧化钡B.碳酸镁,C、氧化铜、D、稀盐酸
理由 .
| 金属离子 | pH | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 6.3 | 9.7 |
| Cu2+ | 4.7 | 6.7 |
| Fe3+ | 1.9 | 3.2 |
(2)实际应用中则是先加一定量的次氯酸钠,然后再调节溶液pH.次氯酸钠的作用是
(3)pH应调节到什么范围
(4)调节pH适宜的试剂是
A.氢氧化钡B.碳酸镁,C、氧化铜、D、稀盐酸
理由
【化学--化学与技术】
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1.其中阴 (阳)离子交换膜只允许阴(阳)离子通过.
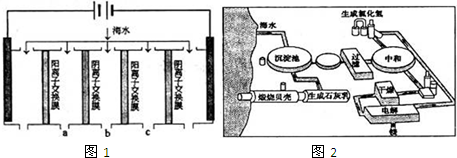
①阴极的电极反应式为 .
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式 .
③淡水的出口为a、b、c中的 出口.
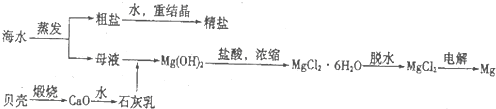
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是 .
②整个生产流程中,循环使用的物质是 .
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是 (填“同意”或“不同意”);理由是 .
海洋是一座巨大的宝藏,海洋资源的开发与利用具有广阔的前景.某地海水的pH在7.5~8.6之间,其中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO 42- | HCO 3+ | 含量/mg?L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |

①阴极的电极反应式为
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式
③淡水的出口为a、b、c中的
(2)如图2是工业上生产镁的流程.
①干燥步骤中将氯化镁的水合晶体转化为无水氯化镁的操作方法是
②整个生产流程中,循环使用的物质是
③有人认为:过滤步骤后,直接加热Mg(OH)2得MgO,再电解熔融的MgO制金属镁,这样可优化生产过程.你的观点是