题目内容
已知硫酸中含有下列微粒:H2O、H+、SO42-,某同学欲证明其中能使石蕊试液变红色的是H+,设计了如下实验:
①取稀盐酸和稀硝酸分别与石蕊试液作用
②向滴有石蕊的稀硫酸中加入NaOH溶液,并观察颜色
③向水中滴入石蕊试液
④向硫酸钠溶液中滴入石蕊试液
其中能证明是H+使石蕊变色的实验是
A.①和③结合 B.③和④结合 C.只②D.只①
①取稀盐酸和稀硝酸分别与石蕊试液作用
②向滴有石蕊的稀硫酸中加入NaOH溶液,并观察颜色
③向水中滴入石蕊试液
④向硫酸钠溶液中滴入石蕊试液
其中能证明是H+使石蕊变色的实验是
A.①和③结合 B.③和④结合 C.只②D.只①
分析:题目的要求是证明能使石蕊试液变红色的是H+.而要证明这个结论,就要把硫酸中其余的粒子使石蕊变色的可能性排除.题目又说已知硫酸中含有H2O、H+、SO42-,所以就要分别排除H2O和SO42-的作用.
解答:解:很明显可以看出③是排除水使石蕊变色的可能,④是排除SO42-使石蕊变色的可能;而对于②,可以发现在加入NaOH的过程中,SO42-和水都一直存在,而H+则渐渐消失,又可以观察到溶液变色,所以可以同时排除SO42-和水的作用,直接证明H+产生的变色的作用;
①和③结合证明①说明稀盐酸和稀硝酸拥有不同的阴离子,所以不是阴离子使石蕊试液变色,但都有的H+和水③说明不是水让石蕊试液变色,所以①和③结合证明H+使石蕊试液变红色;
故选AC.
①和③结合证明①说明稀盐酸和稀硝酸拥有不同的阴离子,所以不是阴离子使石蕊试液变色,但都有的H+和水③说明不是水让石蕊试液变色,所以①和③结合证明H+使石蕊试液变红色;
故选AC.
点评:本题考查了实验验证的实验方案设计和性质验证,题目难度较大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
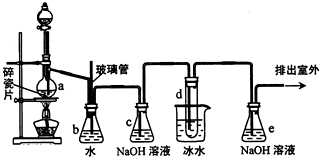 1,2一二溴乙烷可作抗爆剂的添加剂.如图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴.
1,2一二溴乙烷可作抗爆剂的添加剂.如图为实验室制备1,2一二溴乙烷的装置图,图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,试管d中装有液溴.已知:CH3CH2OH
| 浓硫酸 |
| 170℃ |
CH3CH2OH
| 浓硫酸 |
| 140℃ |
相关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g.cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
| 熔点/℃ | -114.3 | 9.79 | -116.2 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(2)安全瓶b在实验中有多重作用.其一可以检查实验进行中导管d是否发生堵塞,请写出发生堵塞时瓶b中的现象;如果实验中导管d堵塞,你认为可能的原因是;安全瓶b还可以起到的作用是
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析可能的原因
(5)除去产物中少量未反应的Br2后,还含有的主要杂质为
(6)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管内,则此时冷水除了能起到冷却1,2一二溴乙烷的作用外,还可以起到的作用是
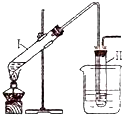 实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:
实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2mL蒸馏水、4mL浓硫酸、2mL95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管Ⅰ至微沸状态数分钟后,冷却.已知:通常情况下,溴乙烷呈液态,其密度比水大且不溶于水.试回答下列问题:(1)试管Ⅰ中硫酸和溴化钠加热反应生成氢溴酸.写出氢溴酸与乙醇在加热时反应的化学方程式
(2)在反应发生后试管II中可观察到的现象是
(3)溴乙烷为无色油状液体.若试管II中获得的有机物呈棕黄色,除去其中的杂质应选用的试剂是
A.CCl4 B.NaOH溶液 C.Na2SO3溶液
利用上述试剂充分洗涤后,分离混合物的操作是
(4)设计实验证明有机物溴乙烷中含有溴元素.完成以下实验报告:
| 实验步骤 | 实验操作 | 预期现象和结论 | ① | 取少量除杂后的溴乙烷于试管中, |
② | 取①中反应后的上层清液少量于另一支试管中, |