��Ŀ����
����Ŀ���������ƣ�NaClO2����һ�ָ�Ч��������Ư������֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO23H2O������38��ʱ����������NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��������ͼ��ʾװ���Ʊ��������ƣ�
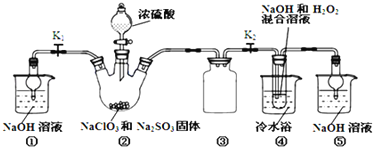
���������գ�
��1��װ�â��в���ClO2�Ļ�ѧ����ʽΪ______��װ�â۵�������______��
��2����װ�âܷ�Ӧ�����Һ���NaClO2����IJ�������Ϊ���ټ�ѹ��55�������ᾧ����______����______���ܵ���60�����õ���Ʒ����ѡ����ʵIJ��������գ�
A����ȴ�����º��� B�����ȹ��� C������ϴ��
D����ˮϴ�� E��38��60�����ˮϴ��
��3��ȷ��ȡ��������������Ʒ10g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ��ClO2��+4I��+4H+�T2H2O+2I2+Cl�����������û��Һ���250mL������Һ�����ƴ���Һ���õ��Ķ�������������______��
��4��ȡ25.00mL����Һ����2.0mol/L Na2S2O3��Һ�ζ���I2+2S2O32���T2I��+S4O62�������Ե�����Һ��ָʾ�����ﵽ�ζ��յ�ʱ������Ϊ________________________________���ظ��ζ�2��3�Σ��������Na2S2O3��Һ�����ƽ��ֵΪ20.00mL������Ʒ��NaClO2����������Ϊ______��
��5��Na2FeO4��ClO2��ˮ���������зֱ𱻻�ԭΪFe3+��Cl��������Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ���ôClO2��Na2FeO4��Cl2��������ɱ����������Ч���ɴ�С��˳����������������������������������������������______���ѧʽ��
���𰸡�2NaClO3+ Na2SO3+ H2SO4��2ClO2+ 2Na2SO4+ H2O��ֹ����BE250mL����ƿ��Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ90.5%ClO2> Cl2>Na2FeO4
��������
���������
���������Ʊ���ʵ���⣬ͼ��װ�â�Ϊ��ȡClO2��װ�ã���Ϊ��ʵ��������Ⱦ�����壬ֱ���ŷŻ���Ⱦ������������Ҫβ������װ�ã�װ�âٺ͢ݾ���������������Һ���շ�Ӧ������ClO2��β����ʵ��ʱ�ر�K1�����з�����Ӧ����ClO2���壬ClO2���徭��װ�â۽���װ�âܷ�Ӧ����װ�â�Ϊ��ȫƿ����ֹװ�â��������¶Ƚ��Ͷ�������������ClO2������װ�â����������ƺ�˫��ˮ��Һ������Ӧ�õ�NaClO2��Һ���������ᾧ�����ˡ�ϴ��������Ȳ������õ�����NaClO23H2O����NaClO2��
��1��������ȡClO2�ķ�Ӧ�NaClO3��Na2SO3��H2SO4��Na2SO3���л�ԭ�ԣ��ڷ�Ӧ������ԭ������������Na2SO4�����ԭ���غ��֪���������л���ˮ���ʻ�ѧ����ʽΪ��2NaClO3 + Na2SO3 + H2SO4=2ClO2 + 2Na2SO4 + H2O��װ�â�Ϊ��ȫƿ����ֹװ�â��������¶Ƚ��Ͷ�����������
��2����ΪNaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2��3H2O������38��ʱ����������NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl����Ҫ�õ�NaClO2���壬����38��~60���¶ȷ�Χ�ڽ��в������ʲ���Ϊ���ȹ��ˣ���38~60�����ˮϴ�ӣ���Ϊ��B E
��3������250mL����Һ��Ҫ�õ��Ķ�������������250mL����ƿ��ע��Ҫָ������ƿ�Ĺ��Ϊ��250mL����ƿ
��4���еⵥ�ʲκ����ɵķ�Ӧ��һ����õ�����Һ��ָʾ�����÷�Ӧ��Na2S2O3��Һ�ζ�����Һ������ζ��յ������Ϊ����Һ����ɫ��Ϊ��ɫ�Ұ�����ڲ���ɫ��
����֪�ɵ÷�Ӧ�Ĺ�ϵʽΪ��ClO2 ~ClO2��~2I2~4S2O32��������n(ClO2��)= ![]() n(S2O32��)=
n(S2O32��)= ![]() ��20��10-3 L��2.0mol/L=0.01mol��m(NaClO2)=0.01mol��90.5g/mol=9.05g ������Ʒ��NaClO2����������Ϊ9.05g��10g��100%=90.5%
��20��10-3 L��2.0mol/L=0.01mol��m(NaClO2)=0.01mol��90.5g/mol=9.05g ������Ʒ��NaClO2����������Ϊ9.05g��10g��100%=90.5%
��5���Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ�����������ɱ������������Ϊm����ôClO2��Na2FeO4��Cl2��������ɱ����������Ч�ʷֱ�Ϊ��![]() ��
��![]() ��
��![]() ��������������ɱ����������Ч���ɴ�С��˳��Ϊ��ClO2>Cl2>Na2FeO4��
��������������ɱ����������Ч���ɴ�С��˳��Ϊ��ClO2>Cl2>Na2FeO4��