题目内容
25℃时,水中存在电离平衡:H2O=H++OH-△H>0.下列叙述正确的是( )
分析:水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小.Kw随温度变化;
解答:解:A、水的电离是吸热过程,加热促进电离,氢离子浓度增大,PH减小,故A错误;
B、向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大,故B错误;
C、向水中加入少量NH4Cl固体,溶解后铵根离子水解促进电离,平衡正向移动,溶液呈酸性,故C错误;
D、向0.1 mol/L的醋酸溶液中加入一定量醋酸钠晶体溶解后醋酸根离子抑制电离,氢离子浓度减小,加水稀释氢离子浓度减小,依据溶液中离子积不变,溶液中c(OH-)均增大,温度不变,但KW不变,故D正确;
故选D.
B、向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大,故B错误;
C、向水中加入少量NH4Cl固体,溶解后铵根离子水解促进电离,平衡正向移动,溶液呈酸性,故C错误;
D、向0.1 mol/L的醋酸溶液中加入一定量醋酸钠晶体溶解后醋酸根离子抑制电离,氢离子浓度减小,加水稀释氢离子浓度减小,依据溶液中离子积不变,溶液中c(OH-)均增大,温度不变,但KW不变,故D正确;
故选D.
点评:本题考查水的电离平衡移动,题目难度不大,注意从浓度、温度对平衡移动的影响角度分析,本题易错点为A,注意升高温度c(H+)增大,pH减小.Kw增大.

练习册系列答案
相关题目
构成物质的微粒种类及相互间的作用力是决定物质表现出何种物质性质的主要因素.
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为______;
(2)氢键作用常表示为“A…HB“,其中A\B为电负性很强的一类原子,如______
(列举三种.X、Y两种物质和部分物质性质如下表,二者物质性质有差异的主要原因是______
(3)钙是人体所需的重要元素之一,有一种补钙剂--抗坏血酸的组成为Ca(C6H7O6)?2H2O]其结构示意图如下: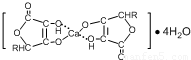
该物质中存在的化学键类型包括______(填字母)
A.金属键B.离子键C.共价键D.配位键
(4)①CH2=CH2、②CH≡CH、③ ④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是______.这四种分子中碳原子采取sp2杂化的是______(填序号).
④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是______.这四种分子中碳原子采取sp2杂化的是______(填序号).
(1)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体类型为______;
| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X |  | 0.2 | 45 | 100 |
| Y |  | 1.7 | 114 | 295 |
(列举三种.X、Y两种物质和部分物质性质如下表,二者物质性质有差异的主要原因是______
(3)钙是人体所需的重要元素之一,有一种补钙剂--抗坏血酸的组成为Ca(C6H7O6)?2H2O]其结构示意图如下:

该物质中存在的化学键类型包括______(填字母)
A.金属键B.离子键C.共价键D.配位键
(4)①CH2=CH2、②CH≡CH、③
 ④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是______.这四种分子中碳原子采取sp2杂化的是______(填序号).
④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是______.这四种分子中碳原子采取sp2杂化的是______(填序号).


 ④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是
④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是