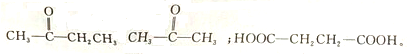题目内容
下列关于二氧化硫的说法,正确的是( )
| A、能漂白某些物质,说明其有氧化性 |
| B、能使紫色石蕊试液变红,说明其水溶液呈酸性 |
| C、能用浓硫酸干燥,说明其不具有还原性 |
| D、能使溴水褪色,说明其具有漂白性 |
考点:二氧化硫的化学性质
专题:
分析:A.能漂白某些物质,与漂白性有关;
B.能使紫色石蕊试液变红,说明二氧化硫为酸性氧化物;
C.能用浓硫酸干燥,与浓硫酸不反应;
D.能使溴水褪色,与溴发生氧化还原反应.
B.能使紫色石蕊试液变红,说明二氧化硫为酸性氧化物;
C.能用浓硫酸干燥,与浓硫酸不反应;
D.能使溴水褪色,与溴发生氧化还原反应.
解答:
解:A.能漂白某些物质,与漂白性有关,与氧化性无关,故A错误;
B.能使紫色石蕊试液变红,说明二氧化硫为酸性氧化物,则其水溶液呈酸性,故B正确;
C.能用浓硫酸干燥,由+4价与+6价之间不存在中间价态可知与浓硫酸不反应,但二氧化硫具有还原性,故C错误;
D.能使溴水褪色,与溴发生氧化还原反应,说明其具有还原性,故D错误;
故选B.
B.能使紫色石蕊试液变红,说明二氧化硫为酸性氧化物,则其水溶液呈酸性,故B正确;
C.能用浓硫酸干燥,由+4价与+6价之间不存在中间价态可知与浓硫酸不反应,但二氧化硫具有还原性,故C错误;
D.能使溴水褪色,与溴发生氧化还原反应,说明其具有还原性,故D错误;
故选B.
点评:本题考查二氧化硫的化学性质,为高频考点,把握二氧化硫的还原性、漂白性、氧化性为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
按Li、Na、K、Rb、Cs顺序逐渐递增的性质是( )
| A、单质的还原性 |
| B、阳离子的氧化性 |
| C、单质的密度 |
| D、单质的熔点 |
如图a为在恒温恒容密闭容器中分别充入X、Y、Z三种气体,一定条件下发生反应各物质浓度随时间的变化.若从t2开始,每个时刻只改变一个且不同的条件,物质Z的正、逆反应速率随时间变化如图b.下列分析不正确的是( )

A、0-t1时,v(Y)=
| ||
| B、t2时刻改变的条件可能是压强或催化剂 | ||
| C、该反应的正反应为放热反应 | ||
| D、该反应中Z一定为产物 |
下列叙述错误的是( )
| A、用新制的银氨溶液可区分甲酸甲酯和乙醛 |
| B、用高锰酸钾酸性溶液可区分己烷和3-己烯 |
| C、用水可区分苯和溴苯 |
| D、用金属钠可区分乙醇和乙醚 |
CH3CH2CHO的说法正确的是( )
| A、所有原子共面 |
| B、C原子采用sp3和sp2杂化 |
| C、三个C原子共线 |
| D、不可能发生加成和取代反 |
下列关于有机物的说法正确的是( )
| A、乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同 |
| B、交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应 |
| C、乙酸的分子式为CH3COOH,属于弱电解质 |
| D、苯分子中没有碳碳双键,因此苯不能发生加成反应 |
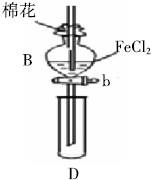 某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe3+和Cl2氧化性强弱比较实验,实验过程如下:
 的物质,该物质是一种香料.
的物质,该物质是一种香料.