题目内容
|
①0.1 L 1 mol·L-1的纯碱溶液逐滴滴入到0.1 L 1.25 mol·L-1的盐酸中; ②将0.1 L 1.25 mol·L-1的盐酸逐滴滴入到0.1 L 1 mol·L-1的纯碱溶液中,两种操作产生CO2的体积比为 | |
| [ ] | |
A. |
5∶2 |
B. |
2∶5 |
C. |
2∶1 |
D. |
1∶1 |
解析:
|
操作①:纯碱滴入盐酸中,发生反应:Na2CO3+2HCl2NaCl+CO2↑+H2O.生成CO2的量由盐酸用量决定:n(CO2)= (1),NaHCO3+HCl (2),则反应(1)消耗盐酸0.1 L×1 mol·L-1=0.1 mol,生成0.1 mol NaHCO3,过量盐酸(0.025 mol)与NaHCO3反应生成0.025 mol CO2,所以n①(CO2)∶n②(CO2)=0.062 5∶0.025=5∶2. |

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案(共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
|
IA |
|
|
|
|
|
|
0 |
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
|
⑦ |
|
⑧ |
|
(1)、④、⑤、⑥的原子半径由大到小的顺序为 (填元素符号)。
②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)。
(2)、①、④、⑤、⑧四种元素中,某些元素间可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(3)、由表中两种元素的原子按 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
a.MnO2 b.Na2SO4 c.Na2SO3 d.CaCO3
(4)、由表中元素形成的物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为 ;
常温下,为使0.1 mol/L M溶液中电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至pH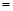 。
。
 题:
题: 2-。
2-。 20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加
20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1 mol·L-1Na2CO3溶液中,溶液中发生反应的离子方程式为: ;向此反应后的溶液中滴加 H++OH- KW=10-14
H++OH- KW=10-14  H++CH3COO--> Ka=1.8×10-5
H++CH3COO--> Ka=1.8×10-5
 =2.2)
=2.2)