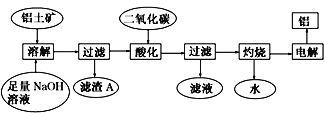
题目内容
【题目】某溶液中只含有以下离子中的全部或部分: Ag+、Fe3+、Al3+、H+、SO42-、CO32-、OH-、Cl-,取该溶液做以下实验:
①观察溶液外观, 溶液有颜色;
②取少量该溶液加入Ba(NO3)2溶液, 无现象;
③取该溶液 100 mL,向其中逐滴滴加 1 mol/L的NaOH溶液至过量,生成沉淀物质的量与所加入的 NaOH 溶液的体积关系如图所示。根据实验回答以下问题:
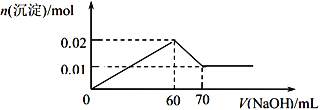
(1)检验溶液中阴离子的离子方程式为________________________________。
(2)根据以上实验推断,溶液中各离子的物质的量浓度分别为________________________________。
(3)若取以上溶液 100 mL,加入足量氨水后过滤,再将所得沉淀洗涤、灼烧,所得固体残留物的物质的量为_____________mol。
【答案】 Ag++Cl-=AgCl↓ c(Fe3+) = c(Al3+)=0.1 mol/L ,c(Cl-) = 0.6 mol/L 0.01 mol
【解析】①观察溶液外观,溶液有颜色,则一定含有Fe3+,因此一定不存在CO32-、OH-;②取少量该溶液加入Ba(NO3)2溶液,无现象,说明不存在SO42-,根据溶液显电中性可知一定存在阴离子Cl-,所以不能存在Ag+;③根据图像可知加入氢氧化钠立即产生沉淀,所以不存在H+,沉淀达到最大值以后继续加入氢氧化钠,沉淀开始减少,但不完全消失,说明还含有Al3+。剩余沉淀是氢氧化铁,物质的量是0.01mol,则氢氧化铝沉淀是0.02mol-0.01mol=0.01mol,根据离子守恒可知溶液中铁离子、铝离子分别是0.01mol、0.01mol,根据电荷守恒可知氯离子的物质的量是0.06mol。
(1)溶液中阴离子是氯离子,检验溶液中阴离子的离子方程式为Ag++Cl-=AgCl↓。(2)根据以上实验推断,溶液中各离子的物质的量浓度分别为铁离子:0.01mol÷0.1L=0.1mol/L、铝离子:0.01mol÷0.1L=0.1mol/L、氯离子:0.06mol÷0.1L=0.6mol/L;(3)若取以上溶液100 mL,加入足量氨水后过滤,得到0.01mol氢氧化铁和0.01mol氧化铝,将所得沉淀洗涤、灼烧得到氧化铁和氧化铝,根据原子守恒可知所得固体残留物的物质的量为0.01mol÷2+0.01mol÷2=0.01mol。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O (g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热).若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 .
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)CO2(g)+H2(g),得到如表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 1000 | 1 | 2 | c | d | t |
①实验B中平衡时H2O (g)的物质的量是 .
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”).
③若实验C中达到平衡所需时间 t3(填“大于”、“等于”或“小于”)