题目内容
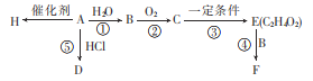
【题目】一种生产聚苯乙烯的流程如下,下列叙述不正确的

A.乙苯的分子式为C8H10B.聚苯乙烯属于高分子化合物
C.lmol苯乙烯最多可与3mol H2发生加成反应D.鉴别苯与苯乙烯可用酸性KMnO4溶液
【答案】C
【解析】
根据框图可知,苯与乙烯在AlCl3的催化下生成乙苯,乙苯在催化剂和一定温度的作用下发生消去反应生成苯乙烯,苯乙烯在一定条件下发生加聚反应生成聚苯乙烯。
A.根据乙苯的结构( )可知,分子式为C8H10,A正确;
)可知,分子式为C8H10,A正确;
B.高分子化合物简称高分子,又叫大分子,一般指相对分子质量超过10000的化合物,聚苯乙烯是指由苯乙烯单体经加聚反应合成的聚合物,属于高分子化合物,B正确;
C.苯乙烯中有苯环和碳碳双键,1个苯环可以与3个H2加成,1个碳碳双键可以与1个H2加成,故lmol苯乙烯最多可与4mol H2发生加成反应,C错误;
D.苯不与酸性KMnO4溶液反应,混合后会分层,苯乙烯与酸性KMnO4溶液反应,使酸性KMnO4溶液褪色,故可用酸性KMnO4溶液鉴别苯与苯乙烯,D正确;
故选C。

 阅读快车系列答案
阅读快车系列答案【题目】乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:

水杨酸 | 醋酸酐 | 乙酰水杨酸 | |
熔点/℃ | 157~159 | -72~-74 | 135~138 |
相对密度/(g·cm﹣3) | 1.44 | 1.10 | 1.35 |
相对分子质量 | 138 | 102 | 180 |
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用__________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有________(填标号),不需使用的_______________________(填名称)。

(3)①中需使用冷水,目的是______________________________________。
(4)②中饱和碳酸氢钠的作用是_________________________________,以便过滤除去难溶杂质。
(5)④采用的纯化方法为____________。
(6)本实验的产率是_________%。
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取出少量黑色固体,洗涤后,__(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3Fe(CN)6溶液,产生蓝色沉淀,说明溶液中含有__。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是__(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量少;溶液红色较30min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于__(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据__现象,判断溶液中存在Ag+,可产生Fe3+。
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的__溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是__,操作及现象是__。
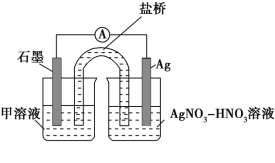
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:__。