题目内容
【题目】铁是生产生活中应用最广泛的金属,炼铁技术备受关注,已知:
①2Fe2O3(s)+3C(s)4Fe(s)+3CO2(g)△H=+460.5KJmol﹣1
②Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)△H=﹣28.5KJmol﹣1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为 .
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a molL﹣1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , 则a(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
Fe2O3 | CO | Fe | |||
1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
2 | 恒温 | 2 | 3 | m | K2 |
3 | 绝热 | 1 | 1.5 | n | K3 |
①T2℃时,容器1中反应的平衡常数K1= .
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)= .
③对于三个容器中的反应,下列说法正确的是(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2 .
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示. 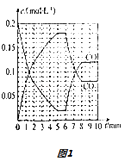
①6min时,改变的外界条件未 , 理由为 .
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)(选填“>”“<”或“=”)v(逆).
(5)CO﹣O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole﹣ , 理论上C口被分离出的气体的物质的量最多为 . 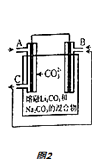
【答案】
(1)834.5kJ
(2)=
(3)64;0.048mol/(L?min);CD
(4)升温;升温,平衡逆向移动,CO浓度增大,CO2浓度减小;<
(5)1mol
【解析】解:(1)根据盖斯定律,将①× ![]() ﹣②×
﹣②× ![]() 得:C(s)+CO2(g)=2CO(g)△H=
得:C(s)+CO2(g)=2CO(g)△H= ![]() +
+ ![]() =172.5kJmol﹣1 . 设断裂1mol C(s)中所有化学键需要吸收的能量为x,则:x=2×1076kJ﹣1490kJ+172.5kJ=834.5kJ,所以答案是:834.5kJ(2)平衡常数只与温度有关,T1℃时,K=c(CO2)=amol/L,故其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , k=b molL﹣1 , 故a=b,
=172.5kJmol﹣1 . 设断裂1mol C(s)中所有化学键需要吸收的能量为x,则:x=2×1076kJ﹣1490kJ+172.5kJ=834.5kJ,所以答案是:834.5kJ(2)平衡常数只与温度有关,T1℃时,K=c(CO2)=amol/L,故其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b molL﹣1 , k=b molL﹣1 , 故a=b,
所以答案是:=(3)①依据反应②热化学方程式计算;
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | △H=﹣28.5KJmol﹣1 | ||
起始量(mol) | 0.5 | 1.5 | 0 | 0 | ||
变化量(mol) | 0.4 | 1.2 | 0.8 | 1.2 | ||
平衡量(mol) | 0.1 | 0.3 | 0.8 | 1.2 |
K1= ![]() =
= ![]() =64
=64
②设5min达到平衡时CO2的物质的量为xmol
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | △H=﹣28.5KJmol﹣1 | ||
起始量(mol) | 2 | 3 | 0 | 0 | ||
变化量(mol) | x/3 | x | 2x/3 | x | ||
平衡量(mol) | 2﹣x/3 | 3﹣x | 2x/3 | x |
K2=K1= ![]() =64=
=64= ![]()
解得:x=2.4mol
v(CO2)= ![]() =0.048mol/(Lmin),
=0.048mol/(Lmin),
所以答案是:0.048mol/(Lmin);
③A.m>2n,错误,分析如下:
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | △H=﹣28.5KJmol﹣1 | ||
起始量(mol) | 2 | 3 | 0 | 0 | ||
变化量(mol) | m /3 | m | 2 m /3 | m | ||
平衡量(mol) | 2﹣m/3 | 3﹣m | 2 m /3 | m |
K2=K1= ![]() =64=
=64= ![]()
解得:m=2.4mol
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | △H=﹣28.5KJmol﹣1 | ||
起始量(mol) | 1 | 1.5 | 0 | 0 | ||
变化量(mol) | n/3 | n | 2n/3 | n | ||
平衡量(mol) | 1﹣n/3 | 1.5﹣n | 2n/3 | n |
K2=K1= ![]() =64=
=64= ![]()
解得:n=1.2mol,故A错误;
B.容器1和容器2中CO的平衡转化率v1<v2 , 错误,根据①②的数据分析如下:
v1= ![]() ×100%=80%;v2=
×100%=80%;v2= ![]() ×100%=80%;故B错误;
×100%=80%;故B错误;
C.K1=K3 , 因温度相同,平衡常数不变,故C正确;
D.平衡时气体压强:P3>P1 , 因n=1.2mol>0.8mol,故D正确.
故选CD.(4)①依据勒夏特列原理,升温,平衡逆向移动,CO浓度增大,CO2浓度减小,
所以答案是:升温;升温,平衡逆向移动,CO浓度增大,CO2浓度减小;
②已知10min时,c(CO2)=0.08mol/L,c(CO)=0.12mol/L,则该温度下的平衡常数K= ![]() =
= ![]() =
= ![]() .
.
由图可知容器的体积V= ![]() =5L,则增加c(CO)=
=5L,则增加c(CO)= ![]() =0.2mol/L,c(CO2)=
=0.2mol/L,c(CO2)= ![]() =0.2mol/L.
=0.2mol/L.
Fe2O3(s)+ | 3CO(g) | 2Fe(s)+ | 3CO2(g) | ||
起始量(mol/L) | 0.12+0.2 | 0.08+0.2 |
浓度商Q= ![]() =
= ![]() >
> ![]() ,反应逆向进行,故v(正)<v(逆).
,反应逆向进行,故v(正)<v(逆).
所以答案是:<;(5)设产生xmolCO2 , 根据2CO+O2═2CO2得关系式:2e﹣~CO2 . 则x=1mol,
所以答案是:1mol.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.