��Ŀ����
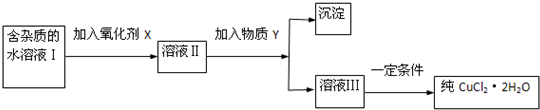
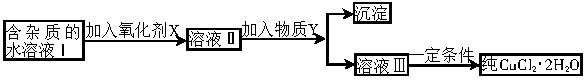
���к�FeCl2���ʵ��Ȼ�ͭ���壨CuCl2��2H2O����Ϊ��ȡ������CuCl2��2H2O�����Ƚ����Ƴ�ˮ��Һ��Ȼ����ͼ��ʾ��������ᴿ��
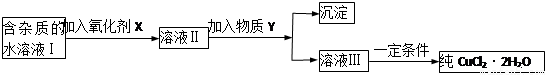

��֪H2O2��KMnO4��NaClO��K2Cr2O7������ǿ�����ԣ�Ҫ����Һ�е�Cu2����Fe2����Fe3������Ϊ�����������Һ��pH�ֱ�Ϊ6.4��6.4��3.7��
��ش��������� [��1��~��2��С������] ��
��1����ʵ�����ʺϵ�������X��__________
A��K2Cr2O7 B��NaClO C��H2O2 D��KMnO4
��2������Y��������___________
A��CuO B��CuCl2 C��Cu��OH��2 D��CuCO3
��3����YΪCu(OH)2��д����ȥFe3�������ӷ���ʽ��
��4��������������Ŀ����_______________________________________��
��5������ܲ���ֱ�������ᾧ�õ�CuCl2��2H2O��__________����ܡ����ܡ������粻�ܣ�Ӧ��β����������ܣ��˿ղ��_______________________________��
(1)C (2)B (3) 2Fe3+ +3Cu(OH)2 = 2Fe(OH)3 +3Cu2+����4����Fe2+ ����Ϊ Fe3+���ٳ�ȥ��5�����ܣ�Ӧ���Ȼ���������Ũ������ȴ�ᾧ
��������
�����������1�����ֶ���ǿ�����������������ּ����������ʳ��֣����õ���CuCl2��2H2O����ѡC����2����������Ϊ�����Ȼ���������Ӧ���ɳ�������B�����Ȼ�����Ӧ����3����ΪKsp��Fe(OH)3��<Ksp( Cu(OH)2)���Լ���Cu(OH)2������Fe(OH)3��������4��Fe3+���ʸ�Ϊ�ȶ�����������ࣻ��5�����ܣ�Ӧ���Ȼ���������Ũ������ȴ�ᾧ��
���㣺�Թ�������Ϊ���������黯ѧ��Ӧ����ԭ��

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д����к�FeCl2���ʵ��Ȼ�ͭ���壨CuCl2?2H2O����Ϊ��ȡ������CuCl2?2H2O�����Ƚ����Ƴ�ˮ��Һ��Ȼ����ͼ��ʾ��������ᴿ��

��֪H2O2��KMnO4��NaClO��K2Cr2O7������ǿ�����ԣ�Ҫ����Һ�е�Cu2+��Fe2+��Fe3+����Ϊ�����������Һ��pH���±���
| �������↑ʼ����ʱ��pH | �������������ȫʱԼpH | |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
��1����ʵ�����ʺϵ�������X��______������ţ���
A��K2Cr2O7��������B��NaClO������ C��H2O2������ D��KMnO4
��2������������Ŀ����______��
��3������Y��______��д��ѧʽ��������Y��Ŀ����______��
��4����ȥFe3+���й����ӷ���ʽ��______��
��5����������Y��õ��ij�����______��д��ѧʽ�������ϴ�Ӹó���������______��
��6������ܲ���ֱ�������ᾧ�õ�CuCl2?2H2O���壿______��Ӧ��β�����______��