题目内容
如下图是某厂生产的某种加钙食盐包装标签上的部分文字。请仔细阅读后回答以下问题:配料表:氯化钠、食用碳酸钙、碘酸钾 净含量:500 g 成分表:氯化钠≥88% 钙(以Ca计)(0.5~13.)% 碘(以I计)(20~50)mg·kg-1 |
(1)包装标签上钙含量是指_______(填“单质钙”“碳酸钙”或“钙元素”中的一种)。
(2)为了检验此盐中是否含有碳酸钙,在家庭厨房里可选用的物质是_______。
(3)为了测定此盐中的钙元素含量,取10 g这种盐溶于水,加入足量盐酸,生成0.132 g二氧化碳。请计算此加钙食盐中钙元素的质量分数_______。
解析:(1)Ca计算的钙含量中的钙显然不是碳酸钙,因单质钙很活泼而不能添加于食盐中,故也不能是单质钙,则只能是钙元素。
(2)在家庭厨房里可找到的能检测此盐中是否含CaCO3的物质有食醋、水。
(3)Ca~CaCO3~CO2
40 g 44 g
m(Ca) 0.132 g
![]()
![]()
答案:(1)钙元素
(2)食醋和水
(3)1.2%


沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
pH | 3.2 | 5.2 | 12.4 |
部分阳离子以氢氧化物形式完全沉淀时溶液的pH见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有________________________(要求写出两条)。
(2)滤渣Ⅰ的主要成分有____________________________。
(3)从滤液Ⅱ中可回收利用的主要物质有________________________。
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3====Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
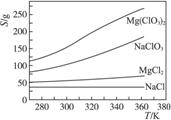
①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因:________________________________________________________________________。
②按①中条件进行制备实验。在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:______________________________。除去产品中该杂质的方法是:_______________________________________________________________________________。



 2Fe2O3
+ 8SO2
2Fe2O3
+ 8SO2
