题目内容
常温常压下,O3为淡蓝色有特殊臭味的气体,工业上常用O3作为造纸、纺织等行业的漂白和脱色剂,也可用作饮用水的消毒和杀菌剂,但O3浓度超标时会因其强氧化性而对人体产生毒副作用。自然条件下打雷时空气中会有部分O2转化为O3。
实验室现提供以下装置和药品,请你完成O3的制备及性质验证实验。
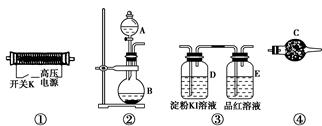
请回答以下问题:
(1)以上装置的连接顺序为______接______接________接________。
(2)A中应装入的试剂为________(写化学式);B中发生反应的化学方程式为____________________________________________________。
(3)检验整个装置的气密性的具体操作是__________________________。
(4)实验开始时,取下分液漏斗的塞子,断开电源开关K,再旋开分液漏斗的活塞,持续通入气体一段时间,其目的是________、________。然后合上电源开关K,试预测下列装置中可能观察到的现象及对应的结论。
D装置中:___________________________________________________;
E装置中:____________________________________________________。
(5)请指出该实验装置中的不妥之处并改进:_________________________。
实验室现提供以下装置和药品,请你完成O3的制备及性质验证实验。

请回答以下问题:
(1)以上装置的连接顺序为______接______接________接________。
(2)A中应装入的试剂为________(写化学式);B中发生反应的化学方程式为____________________________________________________。
(3)检验整个装置的气密性的具体操作是__________________________。
(4)实验开始时,取下分液漏斗的塞子,断开电源开关K,再旋开分液漏斗的活塞,持续通入气体一段时间,其目的是________、________。然后合上电源开关K,试预测下列装置中可能观察到的现象及对应的结论。
D装置中:___________________________________________________;
E装置中:____________________________________________________。
(5)请指出该实验装置中的不妥之处并改进:_________________________。
(1)② ④ ① ③
(2)H2O2 2H2O2催化剂,2H2O+O2↑(或H2O 2Na2O2+2H2O=4NaOH+O2↑,注意对应)
(3)关闭分液漏斗的活塞,用热毛巾捂住烧瓶B,观察D、E的导管口是否有气泡冒出,松手片刻后观察导管内液面是否升高
(4)排出装置中的N2,防止生成氮氧化物干扰实验结果
导入O2进行对比实验,保证结果的准确性 无色溶液变蓝色,导管口产生气泡,试剂瓶上部有淡蓝色气体,证明O3有强氧化性 品红溶液褪色,导管口产生气泡,试剂瓶上部有淡蓝色气体,证明O3有漂白性
(5)没有尾气处理装置,应在E的导管口连接尾气处理装置
(2)H2O2 2H2O2催化剂,2H2O+O2↑(或H2O 2Na2O2+2H2O=4NaOH+O2↑,注意对应)
(3)关闭分液漏斗的活塞,用热毛巾捂住烧瓶B,观察D、E的导管口是否有气泡冒出,松手片刻后观察导管内液面是否升高
(4)排出装置中的N2,防止生成氮氧化物干扰实验结果
导入O2进行对比实验,保证结果的准确性 无色溶液变蓝色,导管口产生气泡,试剂瓶上部有淡蓝色气体,证明O3有强氧化性 品红溶液褪色,导管口产生气泡,试剂瓶上部有淡蓝色气体,证明O3有漂白性
(5)没有尾气处理装置,应在E的导管口连接尾气处理装置
(1)①装置的作用是利用氧气产生臭氧,②装置的作用是制备氧气,③装置的作用是检验臭氧的强氧化性和漂白性,④装置的作用是除去氧气中混有的水蒸气,故装置的连接顺序为②④①③。(2)②装置的作用是制备氧气,可以利用反应2H2O2催化剂,2H2O+O2↑或2Na2O2+2H2O=4NaOH+O2↑来制备。(4)“持续通入气体一段时间”,通入的是氧气,可以排出装置中的N2,防止生成氮氧化物干扰实验结果。KI具有还原性,若无色溶液变蓝色,则证明O3有强氧化性;若品红溶液褪色,则证明O3有漂白性。(5)臭氧“也可用作饮用水的消毒和杀菌剂,但浓度超标时会因其强氧化性而对人体产生毒副作用”,故没有反应完的臭氧应进行处理,在E的导管口连接尾气处理装置。

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目


 等副反应。
等副反应。