题目内容
(1)有一部分化学反应的反应热测定起来很困难,我们可以根据盖斯定律计算获得。如同素异形体之间的转化反应热数值小且转化慢,测定较困难。已知:
①4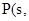 白磷
白磷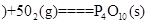 △H=-2983.2KJ/mol
△H=-2983.2KJ/mol
②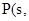 红磷
红磷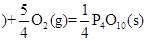 △H=-738.5KJ/mol
△H=-738.5KJ/mol
写出白磷转化为红磷的热化学方程式:__________________________。则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是_______。

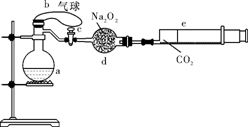
(2)(6分)有右图装置:回答下列问题:
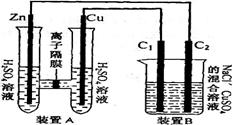
①装置A是_______池,B是_______池。
②装置A中的Zn极是_______极,Cu极上的电极反应方程式为:___。
③锌与铁组成的合金在潮湿的空气中,锌被腐蚀而另一种金属被保护,这种保护方法称为
(1) P(S,白)= P(S,红) △H=-7.3KJ/mol;B
(2)①原电池,电解池
②2H++2e-=H2↑ ③牺牲阳极的阴极保护法
【解析】
试题分析:(1)中,白磷转化为红磷的热化学方程式为:①-② 4=
4=
P(S,白)= P(S,红) △H=-7.3KJ/mol,这说明了白磷转化为红磷为放热反应,生成物的能量比反应物的能量底,故选B;
(2)中,装置A为原电池,装置B为电解池,对于A来说,Zn极是负极,Cu为正极,Cu极上的电极反应方程式为,2H++2e-=H2↑,当锌与铁组成的合金在潮湿的空气中,锌被腐蚀而另一种金属被保护,由于Zn较Fe活泼,所以Zn为阳极,该方法称为牺牲阳极的阴极保护法。
考点:热力学方程,原电池,电解池
点评:该题综合考查了热力学方程,原电池,电解池的相关知识,是高考的常考题型,但是该题比较基础。

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
| ⅠA | 0 | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ④ | ||||||
| 3 | ⑤ | ③ | ⑥ | ⑦ | ||||
(1)④、⑥、⑦的离子半径由大到小的顺序为 。
(2)1971年美国科学家通过细冰获得含元素④的含氧酸(HXO),在与水反应时,两种分子中的共价键分别断裂成两部分,再重新组合,写出该反应的化学方程式 。
(3)①、②两种元素的原子按1:1组成的常见液态化合物的电子式为 。在酸性溶液中该物质能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生下图中的反应,其中B、C、G是单质,B为黄绿色气
体,D溶液显碱性。
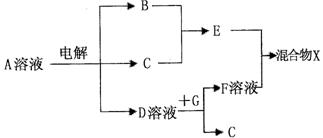
①写出D溶液与G反应的化学方程式 。
②常温下,若电解l L 0.1 mol/L A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
③若仅电解l L 0.1 mol/L A溶液,图中各步反应均为完全转化,而各物质在反应过程中没有损耗,则混合物X中含有的物质有 。