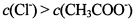题目内容
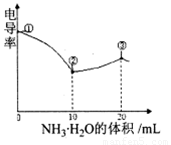
 电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol/LNH3?H2O滴定10.00mL浓度均为0.100mol/L HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小.室温下,用0.100mol/LNH3?H2O滴定10.00mL浓度均为0.100mol/L HCl和CH3COOH的混合溶液,所得曲线如图所示.下列说法正确的是( )分析:A、醋酸是弱酸,在水中不能完全电离,所以不能根据酸的浓度确定氢离子浓度.
B、酸碱中和反应是放热反应,但弱电解质的电离是吸热反应,据此判断溶液的温度大小.
C、根据酸根离子是否水解分析,能水解的离子导致其浓度降低.
D、溶液中离子浓度越小,电导率越小.
B、酸碱中和反应是放热反应,但弱电解质的电离是吸热反应,据此判断溶液的温度大小.
C、根据酸根离子是否水解分析,能水解的离子导致其浓度降低.
D、溶液中离子浓度越小,电导率越小.
解答:解:A、醋酸是弱酸,在水中只有部分电离,导致氢离子浓度小于醋酸的浓度,所以该混合溶液中氢离子浓度小于0.200 mol/L,故A错误.
B、酸碱中和反应是放热反应,弱电解质的电离是吸热反应,当氨水和盐酸反应时放热,但氨水和醋酸反应时因为醋酸电离吸热导致该反应放出的热量小于和盐酸放出的热量,起初是氨水与溶液中H+反应溶液中离子的物质的量未变,但由于溶液体积增大,导致溶液中离子浓度减小,故电导率减小.随着氨水与CH3COOH反应生成醋酸铵,使溶液中自由移动离子的浓度增大,故电导率又增大.所以溶液温度在②时最高,故B错误.
C、③点溶液中,醋酸根离子是弱根离子所以部分水解,氯离子不水解,导致溶液中氯离子浓度大于醋酸根离子浓度,故C正确.
D、③点后,溶液中离子浓度减小导致电导率降低,故D错误.
故选:C.
B、酸碱中和反应是放热反应,弱电解质的电离是吸热反应,当氨水和盐酸反应时放热,但氨水和醋酸反应时因为醋酸电离吸热导致该反应放出的热量小于和盐酸放出的热量,起初是氨水与溶液中H+反应溶液中离子的物质的量未变,但由于溶液体积增大,导致溶液中离子浓度减小,故电导率减小.随着氨水与CH3COOH反应生成醋酸铵,使溶液中自由移动离子的浓度增大,故电导率又增大.所以溶液温度在②时最高,故B错误.
C、③点溶液中,醋酸根离子是弱根离子所以部分水解,氯离子不水解,导致溶液中氯离子浓度大于醋酸根离子浓度,故C正确.
D、③点后,溶液中离子浓度减小导致电导率降低,故D错误.
故选:C.
点评:本题考查了弱电解质的电离,难度较大,明确溶液的电导率有离子浓度有关,浓度越大电导率越大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
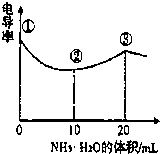 (2013?杭州一模)电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL 浓度均为0.100mol?L-1HCl和CH3COOH的混合液,电导率曲线如图所示.下列说法正确的是( )
(2013?杭州一模)电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol?L-1的NH3?H2O 滴定10.00mL 浓度均为0.100mol?L-1HCl和CH3COOH的混合液,电导率曲线如图所示.下列说法正确的是( )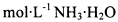 滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()