题目内容
【题目】一种新型钙钛矿太阳能电池具有较高的能量转化率,其组成有多种,主要由![]() 、
、![]() 、
、![]() 、
、![]() ,
,![]() 、
、![]() 、
、![]() 等离子中的某几种组成。
等离子中的某几种组成。
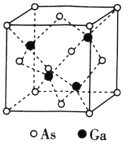
![]() 中运动在能量最高的能级上的电子自旋方向有_____种;氮与左右相邻的两种元素第一电离能由大到小的顺序为_______。
中运动在能量最高的能级上的电子自旋方向有_____种;氮与左右相邻的两种元素第一电离能由大到小的顺序为_______。
![]() 基态铁原子的核外电子排布式为________,铅元素的电子由________
基态铁原子的核外电子排布式为________,铅元素的电子由________![]() 填“激发态”或“基态”
填“激发态”或“基态”![]() 跃迁到另一状态时会产生绿色的焰色反应。
跃迁到另一状态时会产生绿色的焰色反应。
![]() 中碳原子的杂化轨道类型为_______,以N原子为中心的几个微粒的空间构型为_________,该离子中
中碳原子的杂化轨道类型为_______,以N原子为中心的几个微粒的空间构型为_________,该离子中![]() 键之间的键角________
键之间的键角________![]() 中
中![]() 间键角
间键角![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 常温下,
常温下,![]() 、
、![]() 、
、![]() 分别为气体、液体、固体。则
分别为气体、液体、固体。则![]() 的晶体类型为_________,从结构角度解释上述三种物质状态的变化:___________________________。
的晶体类型为_________,从结构角度解释上述三种物质状态的变化:___________________________。
![]() 某钙钛矿太阳能电池材料的晶胞如图所示,其晶胞参数为
某钙钛矿太阳能电池材料的晶胞如图所示,其晶胞参数为![]() 、密度为
、密度为![]() 。
。
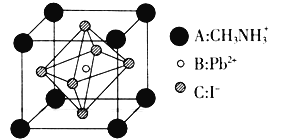
则该晶体中![]() _________,该晶体的摩尔质量
_________,该晶体的摩尔质量![]() _____
_____![]() 用含d、
用含d、![]() 等符号的式子表示,用
等符号的式子表示,用![]() 表示阿伏加德罗常数的值
表示阿伏加德罗常数的值![]() 。
。
【答案】![]()
![]()
![]() 激发态
激发态 ![]() 四面体
四面体 ![]() 分子晶体
分子晶体 ![]() 、
、![]() 、
、![]() 均为组成、结构相似的分子晶体,分子间力作用力随着相对分子质量的增大而增大,故熔点依次升高
均为组成、结构相似的分子晶体,分子间力作用力随着相对分子质量的增大而增大,故熔点依次升高 ![]()
![]()
【解析】
(1)Fe3+的电子排布式为1s22s22p63s23p63d5;同周期自左而右元素第一电离能呈增大趋势;
(2)基态铁原子的核外电子总数是26,根据能级图写出电子排布式,基态原子的电子吸收能量,跃迁到较高能级,电子又从高能级跃迁到低能级,以光的形式释放能量;
(3)CH3NH3+中碳原子和N原子均形成4个电子对;NH3中存在孤对电子;
![]() Cl2、Br2、I2均为分子晶体,相对分子质量越大,分子间作用力越强。
Cl2、Br2、I2均为分子晶体,相对分子质量越大,分子间作用力越强。
![]() 晶胞中A的个数为8×
晶胞中A的个数为8×![]() =1,B为1,而C为6×
=1,B为1,而C为6×![]() =3,再根据
=3,再根据![]() 计算即可。
计算即可。
![]() 能量最高的能级是3d,有5个电子以自旋方向相同的形式占有不同轨道。同一周期从左到右第一电离能增大,但存在N原子的2p轨道为半充满结构,相对稳定,与VIA族(氧)反常变大,故有
能量最高的能级是3d,有5个电子以自旋方向相同的形式占有不同轨道。同一周期从左到右第一电离能增大,但存在N原子的2p轨道为半充满结构,相对稳定,与VIA族(氧)反常变大,故有![]() ;
;
![]() 基态铁原子的核外电子排布式为
基态铁原子的核外电子排布式为![]() ,焰色反应属于由激发态跃迁到基态时产生的;
,焰色反应属于由激发态跃迁到基态时产生的;
![]() 中碳原子、氮原子均形成了4个
中碳原子、氮原子均形成了4个![]() 键,故均为
键,故均为![]() 杂化,相应地五个原子构成的四面体。
杂化,相应地五个原子构成的四面体。![]() 中存在孤电子对,孤对电子与成键电子之间的排斥力强于成键电子与成键电子之间的排斥力,故
中存在孤电子对,孤对电子与成键电子之间的排斥力强于成键电子与成键电子之间的排斥力,故![]() 中
中![]() 间夹角较小;
间夹角较小;
![]() 卤素单质均为分子晶体,物质在常温下的状态与其熔点、沸点有关,而物质的熔点、沸点的高低又与分子间作用力大小有关,作用力越大,熔点、沸点越高,
卤素单质均为分子晶体,物质在常温下的状态与其熔点、沸点有关,而物质的熔点、沸点的高低又与分子间作用力大小有关,作用力越大,熔点、沸点越高,![]() 、
、![]() 、
、![]() 相对分子质量依次增大,分子间作用力越大;
相对分子质量依次增大,分子间作用力越大;
![]() 利用均摊原理求出
利用均摊原理求出![]() 。晶胞的体积为(d×10-10cm)3=
。晶胞的体积为(d×10-10cm)3=![]() ,质量为
,质量为![]() ,则
,则![]() ,解得:
,解得:![]() 。
。

【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:


可能用到的有关数据如下:
物质 | 相对分子质量 | 密度/gcm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置a、b的名称分别是__、__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__。
(4)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是__。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填字母)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是__(填字母)。
A.41% B.50% C.61% D.70%
【题目】X、Y、 Z三种可溶性盐,其阳离子分别是Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、NO3-中的某一种。现做以下实验:
①将三种盐各取少量,分别溶于盛有5 mL蒸馏水的三支试管中,只有X盐溶液呈蓝色。
②分别向三支试管中加入2 mL稀盐酸,发现Y盐溶液中产生白色沉淀,Z盐溶液无明显现象。
(1)根据上述事实,推断这三种盐的化学式:X______,Y______,Z______。
(2)若上述三种阳离子Ba2+、Cu2+、Ag+对应的盐都为硝酸盐,将其混合配成溶液,选择合适试剂,将这三种离子逐一沉淀分离。其流程图如下:

部分物质溶解性表为
Ba2+ | Cu2+ | Ag+ | |
Cl- | 溶 | 溶 | 不 |
CO32- | 不 | 不 | 不 |
SO42- | 不 | 溶 | 微 |
S2- | 溶 | 不 | 不 |
①沉淀1的化学式为_________________。
②写出混合溶液与试剂A反应的离子方程式:______________。
③若C为Na2S,且它与B的阳离子相同,则试剂B的名称是____________。
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是___酸(填强或弱)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式___。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。

已知:Na2CS3+H2SO4=Na2SO4+CS2+H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是___。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为___。(保留1位小数)




