题目内容
1 mol某链烃A,在一定条件下完全裂化成1 mol烷烃B和1 mol烯烃C,生成的混合气体对H2的相对密度为14.5.试通过计算回答下列问题:
(1)写出链烃A可能的结构简式和名称.
(2)烷烃B和烯烃C可能各是什么物质?
(3)如果1 mol B完全燃烧时需要氧气的物质的量是整数,那么C只能是何种烯烃?
答案:
解析:
解析:
|
答案:(1)CH3CH2CH2CH3(正丁烷)或 (2)B为甲烷,C为丙烯;或B为乙烷,C为乙烯 (3)C只能是丙烯 解析:根据质量守恒定律求解 正丁烷裂化有两种情况:C①C②CC,断①处生成CH4和丙烯;断②处生成C2H6和C2H4.异丁烷裂化只有一种情况: 设烷烃B的分子组成为CnH2n+2,相对分子质量为MB;烯烃C的分子组成为CmH2m,相对分子质量为Mc.根据质量守恒定律,链烃A的组成应为Cn+mH2(n+m)+2,可知A为烷烃.据题意:MA=MB+Mc=2×14.5×2=58,14a+2=58,a=4,所以A的分子式为C4H10. (1)A为CH3CH2CH2CH3(正丁烷)或 (2)讨论:n+m=4. 当n=1时,m=3,即B为甲烷,C为丙烯; 当n=2时,m=2,即B为乙烷,C为乙烯; 当n≥3时,m≤1,无意义. (3)从B的燃烧反应来看: CH4+2O2 |

练习册系列答案
相关题目
 (异丁烷)
(异丁烷)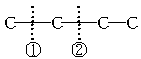 .利用通式及相对分子质量可求出A的分子式,进而写出结构简式.
.利用通式及相对分子质量可求出A的分子式,进而写出结构简式. ,生成CH4和丙烯.
,生成CH4和丙烯.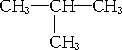 (异丁烷).
(异丁烷).