题目内容
13.为了减少CO对大气的污染,某研究性学习小组拟研究利用CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•moL-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•moL-1
2H2O(g)═H2O(l)△H=-44.0kJ•moL-1
(1)写出CO和H2O(g)作用生成CO2和H2的热化学方程式:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol
(2)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•moL-1
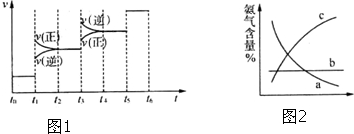
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图1所示.图中t3时引起平衡移动的条件可能是加压,其中表示平衡混合物中NH3的含量最高的一段时间是t2-t3.
②温度为T℃时,将1mol N2和2mol H2放入容积为0.5L的密闭容器中,充分反应后测得N2的平衡转化率为50%.则反应在T℃时的平衡常数为4mol-2•L2.
③目前工业合成氨的原理是:N2+3H2$?_{500℃、铁触媒}^{20-50MPa}$2NH3如图2表示随条件改变,平衡体系中氨气体积分数的变化趋势.当横坐标为压强时,变化趋势正确的是(填序号,下同)c,当横坐标为温度时,变化趋势正确的是a.
(3)常温下氨气和HCl均极易溶于水,现将相同体积、相同物质的量浓度的氨水和盐酸混合,所得溶液中各离子的物质的量浓度按照由大到小的顺序排列依次为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
分析 (1)利用2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol结合盖斯定律来写出CO和 H2O(g)作用生成CO2和H2的热化学方程式;
(2)①根据影响平衡移动的因素结合图象来分析;
②利用N2的转化率结合三段法来计算平衡时的浓度,再利用化学平衡常数的表达式来计算;
③合成氨反应是一个体积减小反应,可以得出随着压强的增大,平衡向氨气增大的方向移动,结合图象可以知道c符合要求.又因为合成氨反应是一个放热反应,可以得出随着温度的升高,平衡向氨气减少的方向移动,结合图象可以知道a符合要求;
(3)将相同体积、相同物质的量浓度的氨水和盐酸混合后,反应生成氯化铵溶液,铵根离子水解.
解答 解:(1)由①2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol、②2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,根据盖斯定律可知$\frac{①-②}{2}$得CO(g)+H2O(g)═CO2(g)+H2(g),△H=$\frac{-566kJ/mol-(-483.6kJ/mol)}{2}$=-41.2kJ/mol,即热化学反应方程式为CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol,
故答案为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol;
(2)①由图象可知,t1时正逆反应速率都增大,则可能为加压或升温,该反应为放热反应,升高稳定,逆向移动,逆反应速率大于正反应速率,与图象不符,该反应是气体体积缩小的反应,加压正向移动,则正反应速率大于逆反应速率,与图象符合,则应为加压;显然图象中的t3时为升高温度,t1时加压正向移动,氨气的含量增大,t3时为升高温度,化学平衡逆向移动,氨气的含量降低,即t2-t3一段时间平衡混合物中NH3的含量最高;
故答案为:加压;t2-t3;
②2molH2和1molN2放入0.5L 密闭容器中,充分反应后测得N2的转化率为50%,则
3H2+N2 2NH3
2NH3
开始(mol/L) 4 2 0
转化 3 1 2
平衡 1 1 2
则该温度下反应的化学平衡常数为K=$\frac{{2}^{2}}{1×{1}^{3}}$=4,
故答案为:4;
③合成氨工业的原理是:N2+3H2$?_{500℃、铁触煤}^{20-50MPa}$2NH3△H<0,因△H<0,从化学平衡的角度看,正反应为放热反应,温度越低,越有利于合成氨,增加温度,平衡向逆反应方向移动,氨气的百分含量减少;正反应为体积缩小的反应,所以压强越大,越有利于合成氨,增大压强时平衡向右进行,氨气的百分含量增大,结合图象可以知道c符合要求.又因为合成氨反应是一个放热反应,可以得出随着温度的升高,平衡向氨气减少的方向移动,结合图象可以知道a符合要求;
故答案为:c;a;
(3)将相同体积、相同物质的量浓度的氨水和盐酸混合后,反应生成氯化铵溶液,铵根离子水解,c(Cl-)>c(NH4+),氯化铵为强酸弱碱盐,水解后溶液呈酸性,c(H+)>c(OH-),水解极其微弱,所以c(NH4+)>c(H+),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评 本题主要考查热化方程式书写、化学平衡的计算、盐类水解等知识,综合性强,有利于学生巩固基础知识和基本技能,难度中等.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 乙醇 | B. | 乙酸 | C. | 乙酸乙酯 | D. | 戊烷 |
| A. | Na2S | B. | NH3 | C. | HClO | D. | Na2O2 |
| A. | 粮食酿酒经历淀粉→葡萄糖→乙醇,每一步均发生氧化还原反应 | |
| B. | 具有氧化性的物质在氧化还原反应中一定作氧化剂 | |
| C. | 在某些反应中可能所有元素的化合价都发生变化 | |
| D. | 单质甲能从盐溶液中置换出单质乙,单质甲一定发生氧化反应 |

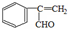
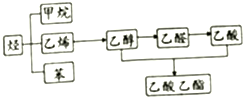 如图是几种重要的有机物及部分转化关系,请回答下列问题:
如图是几种重要的有机物及部分转化关系,请回答下列问题:
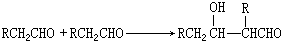
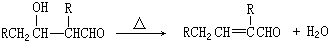
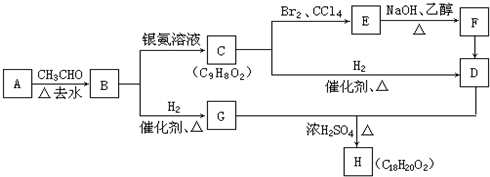
 ;
; +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$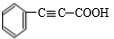 +2NaBr+2H2O
+2NaBr+2H2O +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$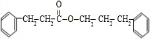 +H2O.
+H2O.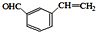 、
、 、
、
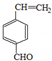 .
.