题目内容
一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:Ⅰ.甲同学的方案如下图所示:
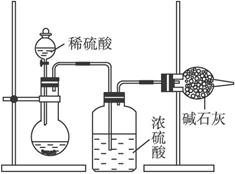
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行_________次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为原因可能是_________(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
Ⅱ.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ___________________________。
(2)洗涤沉淀的操作要点是___________________________。
(3)Ca2+、Ba2+都可以使![]() 沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是___________________________;测定
沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是___________________________;测定![]() 的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是___________________________。
的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是___________________________。
Ⅰ.(1)4
(2)A、B、C、D
Ⅱ.(1)106n/197m
(2)沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2—3次
(3)过量的Ca2+可与OH-生成微溶于水的Ca(OH)2沉淀而影响测定结果 BaCO3相对分子质量比碳酸钙大,在![]() 的量一定的条件下,加入Ba(OH)2溶液生成的沉淀质量多,测定的相对误差较小
的量一定的条件下,加入Ba(OH)2溶液生成的沉淀质量多,测定的相对误差较小
解析:Ⅰ.(1)
称NaOH固体质量为m1 g;反应前称干燥管和碱石灰质量为m2,反应后再称量干燥管和碱石灰质量至少两次,直至两次质量差<0.1 g。
(2)实验前未先排净装置内空气,干燥管后未再连一个干燥管,加硫酸的量不足或生成的CO2没有被完全吸收所以四种情况都可以。
Ⅱ.(1)据Na2CO3—BaCO3关系:得w(Na2CO3)=![]()
(2)沿玻璃棒向过滤器中的沉淀上加蒸馏水至淹没沉淀,静置使其全部滤出,重复2—3次。
(3)过量的Ca2+可与OH-生成微溶于水的Ca(OH)2沉淀而影响测定结果。BaCO3的相对分子质量比CaCO3大,在![]() 的量一定的条件下,加入Ba(OH)2溶液生成的沉淀质量多,测定的的相对误差较小。
的量一定的条件下,加入Ba(OH)2溶液生成的沉淀质量多,测定的的相对误差较小。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案