题目内容
19.在硫酸工业中产生的尾气将对环境造成污染,人类为了充分利用尾气,变废为宝,科学家们设计了很多途径.方案一:用NaOH溶液富集二氧化硫,再向所得生成物中加入某种酸,再将产生的二氧化硫循环利用.
(1)二氧化硫与足量NaOH溶液反应的离子方程式为SO2+2OH-=SO32-+H2O.
(2)向所得生成物中加酸,这种酸可以是BD.
A.硝酸 B.盐酸 C.次氯酸 D.硫酸
方案二:反应中剩余的SO2可用稍过量石灰乳吸收,再通入过量空气充分反应,可制得副产品石膏(CaSO4.2H2O),制取石膏涉及的两个的化学方程式为SO2+Ca(OH)2=CaSO3+H2O,2CaSO3+O2+4H2O=2(CaSO4.2H2O).
方案三:以硫酸工业废气二氧化硫、天然盐湖资源中分离出来的芒硝及焦炭等为原料,生产大苏打和摩尔盐.其主要流程如下,试回答下列问题:

(1)反应Ⅰ的生成物之一是含有S元素的化合物,该化合物中S元素的化合价低于大苏打中S元素的化合价(填“高于”、“低于”或“等于”).
(2)反应Ⅳ中涉及的反应物除H2O、FeSO4外,还有(NH4)2SO4.
分析 方案一:用NaOH溶液富集二氧化硫,再向所得生成物中加入某种酸,再将产生的二氧化硫循环利用,
(1)二氧化硫是酸性氧化物和氢氧化钠溶液反应生成亚硫酸钠溶液;
(2)加入酸反应重新生成二氧化硫气体循环使用,选择的酸不能氧化二氧化硫;
方案二:反应中剩余的SO2可用稍过量石灰乳吸收,再通入过量空气充分反应,可制得副产品石膏(CaSO4.2H2O),
(3)二氧化硫和氢氧化钙反应生成亚硫酸钙浊液,通入过量空气氧化亚硫酸钙为硫酸钙得到副产品石膏;
方案三:以硫酸工业废气二氧化硫、天然盐湖资源中分离出来的芒硝及焦炭等为原料,生产大苏打和摩尔盐,
反应Ⅰ的反应物为Na2SO4和C,生成物为Na2S和CO,硫化钠和亚硫酸钠、二氧化硫反应生成硫代硫酸钠和二氧化碳,分离得到大苏打;
硫酸钠加入碳酸氢铵反应,加入硫酸亚铁溶液,得到摩尔盐;
(1)反应Ⅰ的生成物之一是含有S元素的化合物为硫化钠,化合价低于大苏打中S元素的化合价;
(2)反应Ⅳ中涉及的反应物除H2O、FeSO4外依据原子守恒可知,应含有硫酸铵;
解答 解:方案一:用NaOH溶液富集二氧化硫,再向所得生成物中加入某种酸,再将产生的二氧化硫循环利用,
(1)二氧化硫是酸性氧化物和氢氧化钠溶液反应生成亚硫酸钠溶液,反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O.
(2)加入酸反应重新生成二氧化硫气体循环使用,选择的酸不能氧化二氧化硫,选项中盐酸和硫酸都和亚硫酸钠反应生成二氧化硫气体,次氯酸和硝酸都具有强氧化性,和亚硫酸钠反应发生氧化还原反应,不能生成二氧化硫气体,故选BD,
故答案为:BD.
方案二:反应中剩余的SO2可用稍过量石灰乳吸收,再通入过量空气充分反应,可制得副产品石膏(CaSO4.2H2O),制取石膏涉及的两个的化学方程式为:SO2+Ca(OH)2=CaSO3+H2O,2CaSO3+O2+4H2O=2(CaSO4.2H2O),
故答案为:SO2+Ca(OH)2=CaSO3+H2O,2CaSO3+O2+4H2O=2(CaSO4.2H2O);
(3)二氧化硫和氢氧化钙反应生成亚硫酸钙浊液,通入过量空气氧化亚硫酸钙为硫酸钙得到副产品石膏;
方案三:以硫酸工业废气二氧化硫、天然盐湖资源中分离出来的芒硝及焦炭等为原料,生产大苏打和摩尔盐,
反应Ⅰ的反应物为Na2SO4和C,生成物为Na2S和CO,硫化钠和亚硫酸钠、二氧化硫反应生成硫代硫酸钠和二氧化碳,分离得到大苏打;
硫酸钠加入碳酸氢铵反应,加入硫酸亚铁溶液,得到摩尔盐;
(1)反应物为Na2SO4和C,生成物为Na2S和CO,反应Ⅰ的生成物之一是含有S元素的化合物为硫化钠,反应的化学方程式为Na2SO4+4C=Na2S+4CO,硫化钠中硫元素化合价低于大苏打中S元素的化合价,
故答案为:低于;
(2)反应Ⅳ中涉及的反应物除H2O、FeSO4外依据原子守恒可知,应含有硫酸铵;
故答案为:(NH4)2SO4;
点评 本题考查了物质制备的实验方法分析,物质性质的理解应用,化学方程式和化学式确定,注意元素守恒的应用,掌握基础是解题关键,题目难度中等.

| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 常温常压下,16克氧气含原子数为2NA | |
| C. | 0.1 mol•L-1的 FeCl3溶液Cl-的数目为0.3NA | |
| D. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数为NA个 |
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | OH- | D. | NO${\;}_{3}^{-}$ |
| A. | A的平均反应速率为0.15mol/(L•min) | |
| B. | 平衡时,A的转化率为20% | |
| C. | 平衡时,C的浓度为0.25mol/L | |
| D. | 容器内的起始压强和平衡压强之比为11:10 |
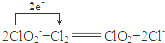 .
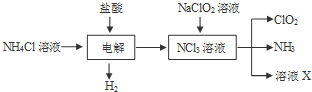
.

 (1)实验室可以测得下列热化学反应方程式:
(1)实验室可以测得下列热化学反应方程式: