题目内容
 (2011?南京模拟)常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
(2011?南京模拟)常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )分析:A、醋酸钠是强碱弱酸盐,其水溶液呈碱性,若要使溶液呈中性,酸的物质的量应稍微大些
B、根据溶液呈电中性,溶液中阴阳离子所带电荷相等.
C、根据溶液中电荷守恒和溶液的酸碱性判断各种离子浓度相对大小.
D、根据醋酸是若电解质,不可能完全电离;
B、根据溶液呈电中性,溶液中阴阳离子所带电荷相等.
C、根据溶液中电荷守恒和溶液的酸碱性判断各种离子浓度相对大小.
D、根据醋酸是若电解质,不可能完全电离;
解答:解:A、醋酸钠是强碱弱酸盐其水溶液呈碱性,要使溶液呈中性,所以醋酸溶液的体积为大于10mL,故A错误;
B、溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(CH3COO-)+(OH-),pH<7时,c(H+)>(OH-),所以
即c(CH3COO-)>c(Na+),故B正确;
C、7<pH<13时,溶液呈碱性,溶液中氢氧根离子浓度大于氢离子浓度,根据溶液中电荷守恒知,溶液中醋酸根离子浓度小于钠离子浓度,但醋酸根离子浓度和氢氧根离子浓度无法比较大小,故C错误;
D、醋酸是若电解质,不可能完全电离,所以溶液pH不可以变为1,故D错误;
故选:B.
B、溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(CH3COO-)+(OH-),pH<7时,c(H+)>(OH-),所以
即c(CH3COO-)>c(Na+),故B正确;
C、7<pH<13时,溶液呈碱性,溶液中氢氧根离子浓度大于氢离子浓度,根据溶液中电荷守恒知,溶液中醋酸根离子浓度小于钠离子浓度,但醋酸根离子浓度和氢氧根离子浓度无法比较大小,故C错误;
D、醋酸是若电解质,不可能完全电离,所以溶液pH不可以变为1,故D错误;
故选:B.
点评:本题考查了溶液酸碱性判断、溶液离子浓度的大小比较,本题难度中等,会根据电荷守恒解本题的关键.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
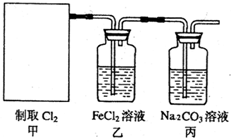 (2011?南京模拟)氯气是一种重要的化工原料.
(2011?南京模拟)氯气是一种重要的化工原料.