题目内容
下列化学反应的离子方程式书写正确的是( )
| A、氯气通入氯化亚铁溶液中:Fe2++Cl2═2Cl-+Fe3+ |
| B、氯气与水反应:Cl2+H2O═Cl-+ClO-+2H+ |
| C、铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| D、三氯化铝中加入过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.根据电荷守恒判断,该离子方程式电荷不守恒;
B.反应生成的次氯酸为弱电解质,不能拆开,应该保留分子式;
C.铜与稀硝酸反应生成一氧化氮气体,根据电荷守恒、质量守恒进行判断;
D.氨水碱性较弱,无法溶解氢氧化铝,反应生成了氢氧化铝沉淀.
B.反应生成的次氯酸为弱电解质,不能拆开,应该保留分子式;
C.铜与稀硝酸反应生成一氧化氮气体,根据电荷守恒、质量守恒进行判断;
D.氨水碱性较弱,无法溶解氢氧化铝,反应生成了氢氧化铝沉淀.
解答:
解:A.氯气将亚铁离子氧化成铁离子,该 离子方程式电荷不守恒,正确的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故A错误;
B.Cl2通入水中反应生成氯化氢和次氯酸,次氯酸应该保留分子式,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故B错误;
C.铜与稀硝酸反应生成一氧化氮气体,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.氨水无法溶解氢氧化铝,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
B.Cl2通入水中反应生成氯化氢和次氯酸,次氯酸应该保留分子式,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故B错误;
C.铜与稀硝酸反应生成一氧化氮气体,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故C正确;
D.氨水无法溶解氢氧化铝,反应生成氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
点评:本题考查了离子方程式的正误判断,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等;选项D为易错点,注意反应产物为氢氧化铝沉淀.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
某一种有机物的结构为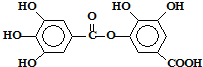 ,关于它的性质的叙述中不正确的是( )
,关于它的性质的叙述中不正确的是( )
 ,关于它的性质的叙述中不正确的是( )
,关于它的性质的叙述中不正确的是( )| A、它可以水解,水解产物只有一种 |
| B、1mol该有机物最多能和8molNaOH反应 |
| C、1mol该有机物最多能和4molBr2发生反应 |
| D、1mol该有机物最多能和8molH2发生加成反应 |
下列金属在一定条件下能够与水反应,且生成金属氧化物的是( )
| A、K | B、Mg | C、Fe | D、Cu |
下列叙述正确的是( )
| A、用电解法精炼粗铜时,粗铜做阴极 |
| B、铜-锌原电池工作时,负极从外电路得到电子 |
| C、用惰性电极电解饱和氯化钠溶液时,在标准状况下,两极产生的气体体积比为1:1 |
| D、用铂电极电解NaOH稀溶液一段时间后,溶液的质量分数不变 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、1 mol碳正离子(CH3+)所含的电子总数为9NA |
| B、28g乙烯所含共用电子对数目为4NA |
| C、标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
下列各项数据中,其比值为2:1的是( )
| A、Na2S溶液中c(Na+)与c(S2-)之比 |
| B、相同温度下,0.2mol/LCH3COOH溶液与0.1mol/LCH3COOH溶液中c(H+)之比 |
| C、pH等于7的氨水与硫酸铵的混合溶液中c(NH4+)与c(SO4-)之比 |
| D、pH=12的KOH溶液与pH=12的Ba(OH)2溶液中c(OH?)之比 |

