题目内容
已知在25℃时:2C(s)+O2(g)=2CO(g) △H1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+82kJ/mol |
B
试题分析:根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减。即△H4=△H3-
 ×△H1-
×△H1- ×△H2=-41kJ/mol,故选B。
×△H2=-41kJ/mol,故选B。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.84 kJ·mol-1
 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①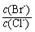 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】 CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):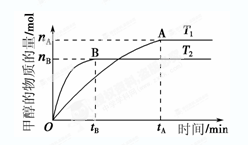
 mol·L-1·min-1
mol·L-1·min-1 增大
增大
 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0)
 2NH3(g);ΔH=-92.4 kJ/mol
2NH3(g);ΔH=-92.4 kJ/mol