题目内容
已知H2、CO、CH4的燃烧热分别为ΔH1=-285.8 kJ/mol、ΔH2=-283 kJ/mol、ΔH3=-890 kJ/mol。H2O(g)=H2O(l) ΔH4=-44 kJ/mol。回答下列问题:
(1)用CH4替代水煤气作家用燃气的优点是____________________。将煤气灶改为天然气灶时,应适当调_________(填“大”或“小”)空气进气阀门。
(2)合成氨厂一般采用烃(以CH4为例)和水蒸气反应制取原料气H2,发生如下反应:CH4(g)+H2O(g)  CO(g)+3H2(g)。
CO(g)+3H2(g)。
①该反应的ΔH=________________。
②当该反应达到平衡状态时,下列说法一定正确的是__________(填字母)。
A.v(CH4)=v(CO) B.加入催化剂,ΔH不变
C.升高温度,平衡常数K增大 D.CH4与H2O的转化率相等
③T℃时,该反应的初始浓度与起始速率的部分数据如下:
初始浓度/mol·L-1 | 起始速率/mol3·L-3·s-1 | |
c(CH4) | c(H2O) | v |
0.10 | 0.10 | 1.0×10-4 |
0.10 | 0.20 | 4.0×10-4 |
0.30 | 0.20 | 1.2×10-3 |
写出起始速率与初始浓度的关系式[用c(CH4)、c(H2O)及适当的速率常数表示]v=________。
④T℃时,在一个体积可变的恒压密闭容器中,充入0.1 mol CH4、0.1 mol H2O(g)发生反应,起始时容器的体积为1 L。CH4的转化率与反应时间的关系如图中曲线A所示。则T℃时该反应的平衡常数K=____________。若温度与投料方式相同,该反应在容积为1 L的恒容密闭容器中进行,刚达平衡状态的点是__________(选填B、C、D、E)。

如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无臭气体放出。符合这一情况的是( )
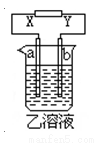
a极板 | b极板 | X电极 | 乙溶液 | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:__________;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为__________mol•L-1
(2)已知水存在如下平衡:H2O?H++OH-△H>0,现欲使平衡向右移动,且所得溶液显碱性,选择方法是__________.
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6 mol•L-1]
D.向水中加入NH4Cl固体
(3)常温下,浓度均为0.1mol•L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是__________,根据表中数据,浓度均为0.01mol•L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是__________(填编号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(4)下列说法不正确的是(填序号〕____________。
A.某温度下纯水中的c(H+)=10-6,故其显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下pH均为8 的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小
(5)实验室中常用NaOH来进行洗气和提纯.当400mL 1mol•L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________.



 C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是
C(g)+D(g),当下列物理量不再发生变化时,表明反应已达平衡的是