题目内容
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①②④⑤ | B.①③④⑤ | C.①②③④ | D.①②④ |
A
解析试题分析:①升高温度,活化分子百分数增大,反应速率增大,正确;②改用100mL 3mol/L盐酸,浓度增大,反应速率增大,正确;③改用300mL 1mol/L盐酸,因浓度不变,则反应速率不变,错误;④用等量锌粉代替锌粒,固体表面积增大,反应速率增大,正确;⑤滴入少量CuSO4溶液,锌置换出铜,形成原电池反应,反应速率增大,正确,故答案为A。
考点:本题考查化学反应速率的影响因素。

 名校课堂系列答案
名校课堂系列答案 已知2SO2 (g)+O2 (g)  2SO3 (g);△H =﹣197kJ?mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
2SO3 (g);△H =﹣197kJ?mol﹣1,向同温、同体积的三个密闭容器中分别充入气体,起始投料量如下表:
| | SO2 (mol) | O2 (mol) | SO3 (mol) |
| 甲 | 2 | 1 | 0 |
| 乙 | 4 | 2 | 0 |
| 丙 | 0 | 0 | 2 |
恒温、恒容下反应达平衡时,下列关系一定正确的是
A.SO3的质量m:2m甲 = m乙
B.容器内压强P:2P丙 > P乙
C.反应放出或吸收热量的数值Q:Q甲 > Q丙
D.c(SO2)与c(O2)之比a:a丙 > a乙
已知N2(g)+3H2(g) 2NH3(g) △H="—92.4" KJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1 mol NH3。现在相同条件下的同一容器中充入x mol N2,y mol H2和2 mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2KJ。则x、y的值分别为( )
2NH3(g) △H="—92.4" KJ/mol。在一恒温恒压的密闭容器里充入2mol N2和8mol H2达到平衡时生成1 mol NH3。现在相同条件下的同一容器中充入x mol N2,y mol H2和2 mol NH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2KJ。则x、y的值分别为( )
| A.1.5, 6.5 | B.2, 8 | C.5, 21 | D.3, 13 |
用足量的铁片与一定量的稀硫酸反应制氢气,下列措施既能使氢气的生成速率加快,又不影响氢气的产量的是( )
| A.滴入适量Na2SO4溶液 | B.不用稀硫酸,改用98%的浓硫酸 |
| C.加入少量碳酸钠固体 | D.不用铁片,改用等质量的铁粉 |
关于化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数,下列说法正确的是
| A.四种平衡常数都是一个比值,没有单位 |
| B.四种平衡常数都是温度的函数,温度升高其值都增大 |
| C.一个化学反应的平衡常数与物质的计量数无关 |
| D.对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度 |
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
| A.容器Ⅰ、Ⅱ中正反应速率相同 |
| B.容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多 |
| D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1 |
对于反应2SO2+O2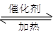 2SO3,下列判断正确的是
2SO3,下列判断正确的是
| A.2 mol SO2和足量的O2反应,一定生成2mol SO3 |
| B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2 |
| C.平衡时SO2的消耗速率等于O2的生成速率的2倍 |
| D.平衡时SO2的浓度为O2浓度的2倍 |
下列条件下化学反应速率最大的是( )
| A.20℃0.1mol·L-1的盐酸溶液20 mL与0.5 g块状碳酸钙反应 |
| B.10℃ 0.1mol·L-1的盐酸溶液20 mL与1 g块状碳酸钙反应 |
| C.10℃ 0.2mol·L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 |
| D.20℃ 0.2mol·L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 |
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是