题目内容
12.在铜锌原电池中,以硫酸为电解质溶液,锌为负极,电极反应式为Zn-2e-=Zn2+,观察到的现象是锌逐渐溶解;铜为正极,电极上发生的反应是还原反应(氧化或还原),电极反应式为2H++2e-=H2↑;铜片上观察到是有气泡产生.分析 Cu、Zn和稀硫酸构成的原电池中,Zn易失电子作负极、Cu作正极,负极上Zn失电子生成锌离子进入溶液,导致锌电极逐渐溶解,正极上氢离子得电子生成氢气,所以看到的现象是铜片上有气泡产生.
解答 解:Cu、Zn和稀硫酸构成的原电池中,Zn易失电子作负极、Cu作正极,负极上Zn失电子生成锌离子进入溶液,电极反应式为Zn-2e-=Zn2+;导致锌电极逐渐溶解,所以看到的现象是:锌逐渐溶解;
正极上氢离子得电子生成氢气,发生还原反应,电极反应式为2H++2e-=H2↑,所以看到的现象是铜片上有气泡产生,故答案为:负;Zn-2e-=Zn2+;锌逐渐溶解;正;还原;2H++2e-=H2↑;有气泡产生.
点评 本题考查原电池原理,明确正负极判断及正负极上发生的反应是解本题关键,会正确书写电极反应式,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.根据表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径 | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6,-2 | -2 |
| A. | 金属性:C>A | B. | 氢化物的稳定性:H2D<H2E | ||
| C. | 单质与稀盐酸反应的速率:A<B | D. | 单质的熔点:A>B>E |
20.下列有机物不能通过乙烯的加成反应制取的是( )
| A. | CH3CH2Cl | B. | CH2Cl-CH2Cl | C. | CH3-CH2OH | D. | CH3-COOH |
5.下列实验方法正确的是( )
| A. | 用氢氧化钠除去铜粉中少量铝粉 | B. | 用淀粉溶液检验食盐中是否加碘 | ||
| C. | 用酚酞试验鉴别KOH和NaOH溶液 | D. | 用焰色反应鉴别NaCl和NaNO3 |

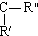 $\stackrel{KMnO4/H+}{→}$RCOOH+
$\stackrel{KMnO4/H+}{→}$RCOOH+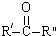
 +H2O
+H2O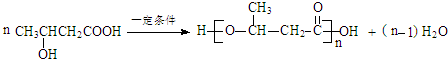 .
. .
.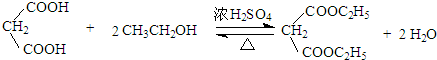 .
.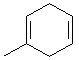 .
.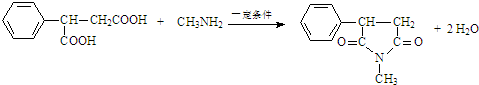 .
.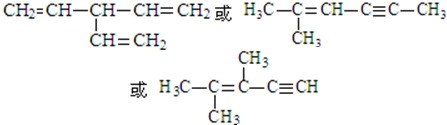 (写出一种即可).
(写出一种即可). .
.
 纯醋酸中不断加入水后,导电能力与加水量的关系如图,请回答有关a、b、c三个点表示的问题:
纯醋酸中不断加入水后,导电能力与加水量的关系如图,请回答有关a、b、c三个点表示的问题: