题目内容
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
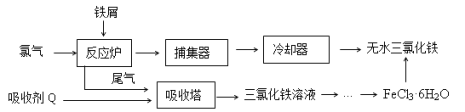
(1)由FeCl3· 6H2O晶体制备无水FeCl3应采取的措施是: 。
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=2.6×10-39)。
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸, 再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000mol·L-1Na2S2O3溶液滴定用去12.50mL。
已知:I2+2S2O32-=2I-+S4O62-
① 写出加入稍过量的KI溶液反应的离子方程式: 。
② 求样品中氯化铁的质量分数(写出计算过程)
【答案】(12分)
(1)在通HCl气体的氛围下加热。(2分)
(2)蒸发浓缩;冷却结晶(每空1分,共2分)
(3)2.6×10-9mol·L-1(2分)
(4)①2Fe3++2I-=2Fe2++I2(2分)
②10ml水样中2Fe3++2I-=2Fe2++I2;I2+2S2O32-=2I-+S4O62-)
n(FeCl3)=2n(I2)=n(Na2S2O3)=12.50mL×10-3L·mL-1×0.1000mol·L-1=1.25×10-3mol(2分)
氯化铁的质量分数=162.5g.mol-1×1.25×10-3mol×10l/2.300g×100%=88.32%(2分)
【解析】
试题解析: (1)尾气中含有氯气,由工艺流程可知,用吸收剂X在吸收塔中吸收氯气,生成氯化铁,所以吸水剂X为氯化亚铁,氯化亚铁与氯气反应生成氯化铁反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;(2)由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加热蒸发、冷却晶体.Fe3+易水解应先加入少量的盐酸,抑制Fe3+水解,再热蒸发、冷却晶体获得FeCl3·6H2O,故答案为:加热浓缩;再冷却结晶;(3)当溶液pH为4时,溶液中c(OH-)=10-10mol/L,Ksp[Fe(OH)3]=c(Fe3+)?c3(OH-)=2.6×10-39,所以溶液中c(Fe3+)= 2.6×10-39/(10-10)3=2.6×10-9mol·L-1,(4)①滴入最后一滴,溶液颜色由蓝色变为无色,半分钟内不再变色,说明滴定到终点,②VmLNa2S2O3溶液含有Na2S2O3物质的量为V×10-3L×cmol/L=c×V×10-3mol,则:
根据关系式:2Fe3+~~I2~~2S2O32-
2 2
n(Fe3+) c×V×10-3mol×10
所以 n(Fe3+)=c×V×10-3mol×10=0.01cVmol,所以m克无水氯化铁样品中氯化铁的质量为0.01c × Vmol × 162.5 g/mol=1.625cVg所以m克无水氯化铁样品中氯化铁的质量分数为162.5g.mol-1 × 1.25 × 10-3mol × 10l/2.300 g × 100%=88.32%
考点:有关物质制备的综合考察。

 名校课堂系列答案
名校课堂系列答案