题目内容
常温时,0.1mol?L-1 HA溶液的pH>1,0.1mol?L-1 BOH溶液
=1012,将上述两溶液等体积混合,下列关于离子浓度关系判断正确的是( )
| c(OH-) |
| c(B+) |
| A、c(H+)<c(OH-)<c(B+)<c(A-) |
| B、c(OH-)<c(H+)<c(B+)<c(A-) |
| C、c(A-)=c(B+)>c(H+)=c(OH-) |
| D、c(H+)+c(B+)=c(OH-)+c(A-) |
考点:离子浓度大小的比较
专题:
分析:常温下,0.1mol/L的一元酸HA溶液其pH>1,说明HA为弱酸,而0.1mol/L的一元碱BOH的溶液中
=1012,由c(OH-)×c(H+)=10-14可知c(OH-)=0.1mol/L,则BOH为强碱,等体积混合生成强碱弱酸盐,结合盐类水解、电荷守恒来分析解答.
| c(OH-) |
| c(B+) |
解答:
解:常温下,0.1mol/L的一元酸HA溶液其pH>1,说明HA为弱酸,而0.1mol/L的一元碱BOH的溶液中c(OH-)/c(H+)=1012,由c(OH-)×c(H+)=10-14可知c(OH-)=0.1mol/L,则BOH为强碱,等体积混合生成强碱弱酸盐,
A-发生水解,溶液呈碱性,所以c(H+)<c(OH-),任何溶液中都存在电荷守恒,根据电荷守恒得:(H+)+c(B+)=c(OH-)+c(A-),故D正确;
结合电荷守恒得:c(A-)<c(B+),该溶液为盐溶液,盐的电离程度大于其水解程度,所以c(OH-)<c(A-),则溶液中离子浓度大小顺序是c(H+)<c(OH-)<c(A-)<c(B+),故ABC错误;
故选D.
A-发生水解,溶液呈碱性,所以c(H+)<c(OH-),任何溶液中都存在电荷守恒,根据电荷守恒得:(H+)+c(B+)=c(OH-)+c(A-),故D正确;
结合电荷守恒得:c(A-)<c(B+),该溶液为盐溶液,盐的电离程度大于其水解程度,所以c(OH-)<c(A-),则溶液中离子浓度大小顺序是c(H+)<c(OH-)<c(A-)<c(B+),故ABC错误;
故选D.
点评:本题考查离子浓度大小比较,题目难度中等,注意根据题目信息判断电解质的强弱为解答该题的关键,根据电荷守恒和盐类水解来分析解答即可.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
尿素[CO(NH2)2]可用于电解制氢气,尿素属于( )
| A、有机物 | B、酸 | C、碱 | D、盐 |
过滤还带灰制取单质碘的实验中,设计的操作正确的且能达到实验目的是( )
A、 装置,过滤海带灰浸取液 装置,过滤海带灰浸取液 |
B、 装置,在滤液中通入Cl2 装置,在滤液中通入Cl2 |
C、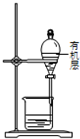 装置,先放出下层液体,再从下口放出有机层 装置,先放出下层液体,再从下口放出有机层 |
D、 装置,回收萃取剂苯并获得单质碘 装置,回收萃取剂苯并获得单质碘 |
下列关于浓硝酸和浓硫酸的叙述正确的是( )
| A、都是常用的干燥剂 |
| B、常温下都能与氢前金属反应放出氢气 |
| C、一定条件下和铜反应中都表现出强氧化性和强酸性 |
| D、分别露置在空气中,容器内溶质的物质的量浓度都增大 |
 有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应:均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.