题目内容
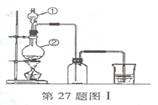
图1是实验室制取氯气的装拦图,根据要求填空回答.
(1)填写仪器名称:图中①是
(2)烧瓶中发生反应的化学方程式是
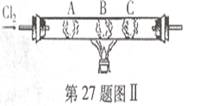
(3)如图2所示,在硬质玻璃管中的A、B、C三处放有喷上少量KBr溶液、KI溶液、淀粉溶液的三个棉球.向左端导入Cl2,在B处加热,可观察到A处棉球呈
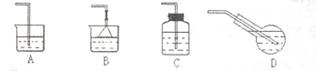
(4)若制备饱和氯水,应选用的最佳吸收装置如图3是
(5)若实验中使用12mol/L的浓盐酸10ml与足量的MnO2反应,则生成Cl2的物质的量是
A.大于O.03mol B.小于O.03mol C.等于0.93mol.
分析:(1)根据装置图和实验操作分析;
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气、水;
(3)氯气能氧化KBr溶液和KI溶液,分别生成Br2和I2,根据物质的性质分析;
(4)氯气的溶解度不大,不需要防倒吸,氯气易挥发据此分析;
(5)氯化氢不能全部反应.
(2)二氧化锰与浓盐酸反应生成氯化锰、氯气、水;
(3)氯气能氧化KBr溶液和KI溶液,分别生成Br2和I2,根据物质的性质分析;
(4)氯气的溶解度不大,不需要防倒吸,氯气易挥发据此分析;
(5)氯化氢不能全部反应.
解答:解:(1)向圆底烧瓶中加液体,根据装置图可知仪器①为分液漏斗,故答案为:分液漏斗;
(2)在加热条件下,二氧化锰与浓盐酸反应生成氯化锰、氯气、水,其反应的化学方程式为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O;
(3)氯气能氧化KBr溶液和KI溶液,分别生成Br2和I2,溴水为橙色,A处棉球呈橙色,B处棉球中生成的碘单质溶液呈黄色,碘单质遇到淀粉变蓝色,所以C处棉球先蓝色,故答案为:橙;黄;蓝;
(4)A、氯气溶解度不大,易挥发,故A不选;
B、氯气的溶解度不大,不需要防倒吸,所以不用B装置,故B不选;
C、C装置密封,气体难以通入,故C不选;
D、氯气易挥发,D装置能加大氯气与水的接触面积,有利于氯气的吸收,故D选;
故答案为:D;
(5)实验中使用12mol/L的浓盐酸10ml与足量的MnO2反应,若HCl全部反应则生成O.03mol 氯气,实际上当反应进行到一定程度浓盐酸变稀,反应会停止,所以氯化氢不能全部反应,故生成Cl2的物质的量小于O.03mol,
故答案为:B.
(2)在加热条件下,二氧化锰与浓盐酸反应生成氯化锰、氯气、水,其反应的化学方程式为:4HCl(浓)+MnO2
| ||
故答案为:4HCl(浓)+MnO2
| ||
(3)氯气能氧化KBr溶液和KI溶液,分别生成Br2和I2,溴水为橙色,A处棉球呈橙色,B处棉球中生成的碘单质溶液呈黄色,碘单质遇到淀粉变蓝色,所以C处棉球先蓝色,故答案为:橙;黄;蓝;
(4)A、氯气溶解度不大,易挥发,故A不选;
B、氯气的溶解度不大,不需要防倒吸,所以不用B装置,故B不选;
C、C装置密封,气体难以通入,故C不选;
D、氯气易挥发,D装置能加大氯气与水的接触面积,有利于氯气的吸收,故D选;
故答案为:D;
(5)实验中使用12mol/L的浓盐酸10ml与足量的MnO2反应,若HCl全部反应则生成O.03mol 氯气,实际上当反应进行到一定程度浓盐酸变稀,反应会停止,所以氯化氢不能全部反应,故生成Cl2的物质的量小于O.03mol,
故答案为:B.
点评:本题考查了氯气制备的发生装置、收集装置的选择方法、反应原理,氯气的性质等,涉及的知识点较多,侧重于基础知识考查,只要熟练掌握氯气的性质及制备原理即可解答.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目


 (1)填写仪器名称:图中①是
(1)填写仪器名称:图中①是